Acid acetic
| Acid etanoic | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Formula scheletică și reprezentarea 3D a acidului acetic | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificare | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Numele IUPAC | acid etanoic | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numele sistematic | acid acetic | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sinonime |
acid acetic glacial |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o ECHA | 100.000.528 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o EC | 200-580-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o RTECS | AF1225000 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Codul ATC | G01 S02 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DrugBank | DB03166 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 176 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ChEBI | 15366 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o E | E260 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| FEMA | 2006 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ZÂMBETE |
CC (= O) O , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
InChI: InChI = 1 / C2H4O2 / c1-2 (3) 4 / h1H3, (H, 3,4) / f / h3H |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspect | lichid incolor cu miros înțepător și puternic oțet. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietăți chimice | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Formula brută |
C 2 H 4 O 2 [Izomeri] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masă molară | 60,052 ± 0,0025 g / mol C 40%, H 6,71%, O 53,29%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| pKa | 4,76 la 25 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Momentul dipolar | 1,70 ± 0,03 D | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diametrul molecular | 0,442 nm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietăți fizice | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fuziune | 16,64 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fierbere | 117,9 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solubilitate | Miscibil cu apă, acetonă , alcool, benzen , glicerol , eter, tetraclorură de carbon ; Practic insolent. în disulfură de carbon | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Parametrul de solubilitate δ | 20,7 MPa 1/2 ( 25 ° C ); 18,9 J 1/2 cm −3/2 ( 25 ° C ); |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
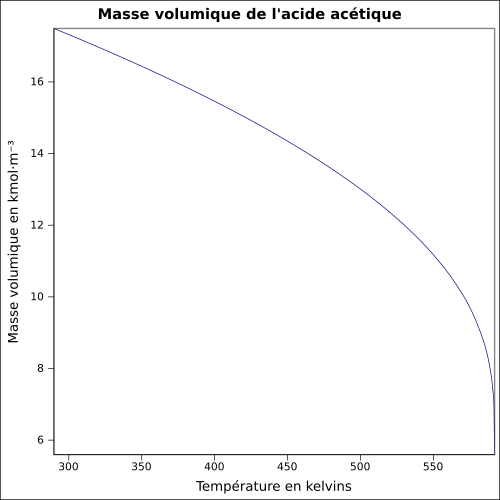
| Masa volumică |
1,049 2 g cm −3 (lichid, 20 ° C )
ecuaţie:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Temperatura de autoaprindere | 465 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punct de aprindere | 39 ° C (cupă închisă) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Limite explozive în aer | 5,4–16 % vol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presiunea saturată a vaporilor |
1,5 kPa la 20 ° C
ecuaţie:

|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vascozitate dinamica | 1,22 mPa s la 25 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punct critic | 4,53 MPa la 319,56 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termochimie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S 0 gaz, 1 bar | 282.848 J mol −1 K −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S 0 lichid, 1 bar | 158,0 J mol −1 K −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ f H 0 gaz | −433 kJ mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ f H 0 lichid | −483,52 kJ mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ fus H ° | 11,728 kJ mol -1 până la 16,75 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ vap H ° | 23,7 kJ mol −1 până la 117,95 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C p |
123,1 J mol −1 K −1 (lichid, 25 ° C ) 63,44 J mol −1 K −1 (gaz, 25 ° C ) ecuaţie:
ecuaţie:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| BUC | 874,2 kJ mol −1 (lichid) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PCI | −875,16 kJ mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietăți electronice | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 re energie de ionizare | 10,65 ± 0,02 eV (gaz) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cristalografie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Clasa de cristal sau grup spațial | Pna 21 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Parametrii mesh |
a = 13.151 Å b = 3,923 Å |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volum | 297,27 Å 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietati optice | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Indicele de refracție | 1,3720 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Precauții | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  Pericol H226, H314, P280, P305, P310, P338, P351, H226 : Lichid și vapori inflamabili H314 : Provoacă arsuri severe ale pielii și leziuni oculare P280 : Purtați mănuși de protecție / îmbrăcăminte de protecție / protecție a ochilor / protecție a feței. P305 : Dacă aveți ochi: P310 : Apelați imediat un CENTRU DE TOXICOLOGIE sau un medic / medic. P338 : Scoateți lentilele de contact dacă victima le poartă și poate fi ușor îndepărtată. Continuați să clătiți. P351 : Clătiți cu atenție cu apă timp de câteva minute. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  B3, E, B3 : Punct de inflamabilitate al lichidului combustibil = 39 ° C cupă închisă (metoda nu este raportată) E : Material coroziv Transportul mărfurilor periculoase: clasa 8 Divulgare la 1,0% conform listei de divulgare a ingredientelor |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 3 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transport | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
83 : coroziv sau care prezintă un grad minor de corozivitate și inflamabil (punct de aprindere 23 până la 60 ° C , inclusiv valorile limită) Număr ONU : 2789 : SOLUȚIE ACIDĂ ACETICĂ care conține peste 80% acid (masic); sau ACID ACETIC GLACIAL Clasa: 8 Etichete: 8 : Substanțe corozive 3 : Lichide inflamabile Ambalare: Grupa de ambalare II : substanțe periculoase medii;  
80 : coroziv sau care prezintă un grad minor de corozivitate Număr ONU : 2790 : ACETIC ACID SOLUTION Clasa: 8 Etichetă: 8 : Substanțe corozive Ambalare: Grupa de ambalare II / III : substanțe moderat / ușor periculoase.  |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ecotoxicologie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DL 50 | 3,31 g kg -1 (șobolan, oral ) 525 mg kg -1 (șoarece, iv ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LogP | -0,31 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pragul mirosului | scăzut: 0,03 ppm înalt: 0,15 ppm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Compuși înrudiți | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izomer (i) | Glicolaldehidă | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Alți compuși | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unități de SI și STP, cu excepția cazului în care se prevede altfel. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Acidul etanoic sau acidul acetic este un acid carboxilic cu C2 catenă de carbon teoretic, similar cu etanul , masa molară de 60 g / mol și formula chimică brută C 2 H 4 O 2 , semi-dezvoltate CH 3 - CO-OH sau AcOH formarea scurt , în cazul în care Ac înseamnă „ CH 3 CO “, din gruparea acetil . Adjectivul numelui comun provine din latinescul acetum , adică oțet . Într-adevăr, acidul acetic reprezintă principalul constituent al oțetului după apă, deoarece îi conferă gustul său acid și mirosul său înțepător detectabil de la 1 ppm .
Distilarea oțetului, atestată din timpurile medievale din Europa, a făcut posibilă obținerea acidului acetic pur, un lichid incolor combustibil cu un miros puternic de oțet, cu o densitate de aproximativ 1,05 g cm −3 la 20 ° C care se solidifică prin imersiune simplă într-o baie cu gheață-apă. Este încă cunoscut sub numele de acid acetic glacial sau oțet anterior puternic . Este primul acid industrial cunoscut.
Acest lichid foarte slab conductiv, incolor, inflamabil și higroscopic reprezintă la temperatura camerei unul dintre cei mai simpli acizi monocarboxilici , împreună cu acidul formic . Aciditatea sa caracterizată printr-o soluție apoasă de pK a = 4,76 provine din capacitatea sa de a pierde temporar protonul funcției sale carboxilice , transformându-l astfel într-un ion acetat CH 3 COO - . Este un acid slab .
Acest acid coagulează latexul și are proprietăți bacteriostatice, ceea ce îi permite să fie utilizat ca dezinfectant. De asemenea, este utilizat ca component al insecticidelor și al agentului de curățare pentru fabricarea semiconductoarelor. Este coroziv și vaporii săi sunt iritanti pentru nas și ochi.
Foarte coroziv pentru țesuturile organice și vii, acesta trebuie manipulat cu grijă. Deși nu s-a constatat că este cancerigen sau dăunător mediului, poate provoca arsuri, precum și leziuni permanente la nivelul gurii, nasului, gâtului și plămânilor. La anumite doze și în coexpoziție cronică cu un produs cancerigen, natura sa iritantă îl face un promotor tumoral al tumorilor (benigne și maligne). Acest lucru a fost demonstrat experimental la șobolani.
În corpul uman , acidul acetic este produs în mod normal după consumul de alcool : etanolul este transformat în acetaldehidă care este apoi transformat în acid acetic sub influența enzimei acetaldehidă dehidrogenază și apoi în acetil-coA de acetat-CoA ligază.
Producție
Cererea globală de acid acetic este de aproximativ 6,5 milioane de tone pe an (Mt / a). Industrial, este produs de oxidarea n- butanului în fază lichidă sau este recuperat în producția de acetat de celuloză sau alcool polivinilic .
Utilizări
Este un reactiv utilizat pe scară largă în industrie sau laboratoare, în special:
- ca solvent: miscibil cu apă și diferiți solvenți organici precum etanol , dietil eter , glicerol dar insolubil în disulfură de carbon , este, de asemenea, un bun solvent pentru gingii , rășini , fosfor , sulf și acizi hidroalici ? ;
- în producția de anhidridă acetică , acetat de celuloză , monomer de acetat de vinil și alți acetați, precum și medicamente , pesticide , coloranți , fabricarea produselor fotografice;
- în alimente (producția de oțete de fructe etc.), aditiv alimentar ;
- textil ;
- ca agent de curățare (pentru semiconductori );
- coagulant ( latex natural);
- bacteriostatic (în soluție);
- la fabricarea materialelor plastice, cum ar fi polietilen tereftalat (PET) sau acetat de celuloză , utile pentru producerea de acetat de vinil (vopsele, adezivi) și solvenți organici;
- ca aditiv în produsele din tutun ( aromatizante ).
- gravare în timpul colorării secțiunilor histologice (de exemplu: colorare carmino-verde )
- proces de hidroliză , condensare și / sau gelificare în fabricarea catalizatorului sau în timpul procesului sol-gel
- acidificarea antibacteriană și gastrică la reproducere, în special la porci.
Nomenclatură
Fostul nume trivial acid acetic derivă din cuvântul acetum latin care înseamnă oțet sau aceti-vinum . Este în continuare cel mai utilizat în lumea francofonă și engleză, dar IUPAC a standardizat termenul de acid etanoic , în locul vechiului nume chimic francez acid etilic . Mai tolerante decât nomenclatura IUPAC din 1960, Chemical Abstracts a păstrat totuși denumirile comune pentru primii doi acizi carboxilici în C1 și C2, acid formic și acid acetic.
Acidul acetic glacial este, de asemenea, un nume trivial care se referă în mod obișnuit la acid acetic pur din laborator. Similar cu numele german "Eisessig" (literal: oțet cu gheață), acest nume este explicat de cristalele de gheață de acid acetic care se formează la o temperatură ușor sub temperatura camerei (sub 17 ° C). , Punctul de topire al aceticului pur acid).
Cea mai comună prescurtare pentru acid acetic este AcOH sau HOAc, Ac denotând gruparea funcțională acetil CH 3 −CO−.
Formula moleculară de acid acetic este C 2 H 4 O 2 . De asemenea, este scris adesea CH 3 COOH sau CH 3 CO 2 H pentru a-și traduce mai bine structura. Ionul rezultat din pierderea protonului H + se numește acetat. Acetatul se poate referi și la o sare care conține acest anion sau la un ester al acidului acetic.
Istoric
Oțetul puternic este cunoscut în Mesopotamia de peste 3000 de ani î.Hr. AD . De bacterii de acid acetic care produc acid acetic din vin și oxigen au fost descrise de către chimistul Louis Pasteur . Sunt prezenți în întreaga lume civilizată, iar orice cultură care prepară bere sau vin a descoperit inevitabil oțetul, rezultatul natural al evoluției acestor băuturi alcoolice lăsate în aer liber.
Utilizarea acidului acetic în chimie datează din Antichitate. La III - lea secol î.Hr.. AD , filosoful grec Teofrast descrie modul în care oțetul acționează asupra metalului și astfel produce pigmenți utili pentru artă, inclusiv plumb alb ( carbonat de plumb ) și verdigris , un amestec verde de săruri de cupru, inclusiv acetat de cupru II (toate produsele toxice ). Vechii romani fierbeau „ vin acru ” în vasele de plumb pentru a produce un sirop foarte dulce numit sapa . Sapa era bogat în acetat de plumb , o substanță dulce numită zahăr de plumb sau zahăr de la Saturn și care a cauzat numeroase otrăviri cu plumb în aristocrația romană, boala care corespunde otrăvirii acute sau cronice cu plumb se numește în special otrăvire cu plumb . Persan alchimist Geber (Geber) concentrat acidul acetic din oțet prin distilare .
În timpul Renașterii , acidul acetic „glacial” a fost preparat prin distilarea uscată a acetaților metalici. În secolul al XVI- lea, alchimistul german Andreas Libavius în procedura descrisă și a comparat acidul pur astfel produs acru. Prezența apei în oțet are o influență atât de mare asupra proprietăților acidului acetic încât, de secole, mulți chimiști au crezut că acidul acetic glacial și acidul din oțet sunt două substanțe diferite. Chimistul francez Pierre Auguste Adet a fost cel care a dovedit că sunt aceiași compuși chimici.
În 1847, chimistul german Hermann Kolbe a sintetizat pentru prima dată acid acetic din materiale anorganice. Secvența acestei reacții a fost clorurarea de sulfură de carbon la tetraclorură de carbon , urmată de piroliză la tetracloretilena și o clorinare a apei în acid tricloracetic , și în final se încheie cu o reducere prin electroliza pentru a se obține acid acetic.
Până în 1910 , cea mai mare parte a acidului acetic glacial a fost obținut din „băutura pirolignă” produsă prin distilarea lemnului. Acidul acetic a fost izolat prin tratament cu hidroxid de calciu , iar acetatul de calciu astfel obținut a fost apoi acidulat prin adăugarea de acid sulfuric pentru a reforma acidul acetic. La acea vreme, Germania producea 10.000 de tone pe an, din care 30% erau utilizate pentru producția de colorant indigo .
Proprietăți fizico-chimice
Aciditate
Atomul de hidrogen (H) al grupării carboxil (–COOH) al acizilor carboxilici, cum ar fi acidul acetic, poate fi eliberat ca un ion H + ( proton ). Abilitatea de a elibera acest proton este cea care îi conferă aciditate. Acidul acetic este un acid slab , mono-proton în soluție apoasă, cu un pK a de aproximativ 4,8 acompaniat de de 25 ° C . O soluție de 1,0 mol / L (concentrația de oțet de uz casnic) are un pH de 2,4, ceea ce înseamnă că doar 0,4% din moleculele de acid acetic sunt disociate.
Dimer ciclic
Structura cristalină a acidului acetic arată că moleculele se împerechează în dimeri conectați prin legături de hidrogen . Aceste dimerii pot fi observate , de asemenea , în formă gazoasă , la 120 ° C . Probabil că sunt prezenți și în faza lichidă a acidului acetic pur, dar sunt repartiți rapid la cea mai mică prezență a apei. Această dimerizare există în alți acizi carboxilici. De asemenea, are loc în soluție apoasă cu o constantă de asociere K D a cărei valoare este apropiată de 1.
Solvent
Acidul acetic lichid este un solvent protic hidrofil ( polar ), similar cu etanolul și apa . Cu o constantă dielectrică medie de 6,2, poate dizolva nu numai compușii polari precum sărurile anorganice și zaharurile , ci și compușii nepolari precum uleiurile sau substanțele pure precum sulful și diodina . Se amestecă ușor cu mulți alți solvenți polari sau nepolari, cum ar fi apa, cloroformul sau hexanul . Aceste proprietăți de solvent și miscibilitatea acidului acetic îl fac utilizat pe scară largă în industria chimică.
Reacții chimice
Acidul acetic este coroziv pentru multe metale , inclusiv fier , magneziu și zinc . Formează hidrogen și săruri metalice numite acetați . Aluminiu formate la contactul cu oxigenul un strat subțire de oxid de aluminiu este relativ rezistentă, care acoperă suprafața sa. Rezervoarele din aluminiu sunt, prin urmare, adesea utilizate pentru transportul acidului acetic. Acetații metalici pot fi produși din amestecul de acid acetic și o bază adecvată, ca în reacția bicarbonat de sodiu + oțet care dă apă și CO 2 . Cu excepția notabilă a acetatului de crom (II) , aproape toți acetații sunt solubili în apă.
- Mg ( s ) + 2 CH 3 COOH ( aq ) → (CH 3 COO) 2 Mg (aq) + H 2 ( g )
- NaHCO 3 (s) + CH 3 COOH (aq) → CH 3 COONa (aq) + CO 2 (g) + H 2 O ( l )

Acidul acetic suferă, de asemenea, reacțiile tipice ale acizilor carboxilici , în special formarea etanolului prin reducere și formarea derivaților, cum ar fi clorura de acetil, prin substituirea nucleofilă a acilului . Printre alți derivați substitutivi se numără anhidrida acetică . Această anhidridă este rezultatul pierderii unei molecule de apă de către două molecule de acid acetic. Esteri ai acidului acetic poate fi antrenat prin esterificare Fischer , și poate fi de asemenea folosite pentru a produce amide . Încălzit la peste 440 ° C , acidul acetic se descompune în dioxid de carbon și metan sau apă și cetenă .
Detectare
Acidul acetic poate fi detectat prin mirosul său caracteristic. Sărurile de acid acetic dizolvate în soluția de clorură de fier (III) dau o culoare roșu intens care dispare după acidificare. Prin încălzirea acetaților cu trioxid de arsen , se obține oxid de cacodil care poate fi identificat prin vaporii săi miroși.
Biochimie
Grupul acetil , derivat din acid acetic, este fundamental pentru biochimia aproape toată viața. Când legat de coenzima A , este de o importanță centrală în metabolismul de glucide și lipide . Cu toate acestea, concentrația de acid acetic liber în celule este menținută scăzută, pentru a nu perturba controlul pH-ului. Spre deosebire de alți acizi carboxilici cu lanț lung de carbon ( acizi grași ), acidul acetic nu apare în formarea trigliceridelor naturale. Există o trigliceridă artificială a acidului acetic, triacetina (triacetat de gliceril), care este utilizată în mod obișnuit ca aditiv alimentar (în cosmetice, alimente și unele medicamente) și ca solvent .
Acidul acetic este produs și secretat în mod natural de anumite bacterii, în special Acetobacter și Clostridium acetobutylicum (ro), precum și drojdia Saccharomyces cerevisiae .
Aceste bacterii sunt prezente în anumite alimente, apă, lapte ( bacterii lactice ) și sol , iar acidul acetic se formează în mod natural atunci când fructele sau alte alimente se descompun. Acidul acetic este, de asemenea, o componentă a lubrifierii vaginale la om și la alte primate , unde pare să funcționeze ca un agent antibacterian .
Producție și sinteză
Acidul acetic este produs sintetic sau prin fermentare bacteriană. Astăzi, metoda organică se referă doar la 10% din producție, dar rămâne importantă pentru fabricarea oțetului, deoarece, în majoritatea țărilor, legea prevede că oțetul de uz alimentar trebuie să fie de origine organică. Aproximativ 75% din acid acetic pentru industria chimică este produsă prin carbonilarea de metanol , a se vedea detaliile de mai jos. Restul este alcătuit din diverse metode alternative.
Producția totală de acid acetic este estimată la 5 Mt / a (milioane de tone pe an), din care aproximativ jumătate provine din Statele Unite. Producția europeană este în jur de 1 Mt / a și este în scădere. În cele din urmă, în Japonia se produc 0,7 Mt / a . 1,5 Mt / a sunt reciclate, ceea ce aduce piața mondială la 6,5 Mt / a . Cei mai mari doi producători sunt Celanese și BP Chimie. Principalii producători sunt, de asemenea, Millenium Chimie, Sterling Chimie, Samsung, Eastman și Svens Etanolkemi.
Carbonilarea metanolului
Cea mai mare parte a acidului acetic nereciclabil este produs prin carbonilarea de metanol . În acest proces, metanolul și monoxidul de carbon reacționează pentru a produce acid acetic conform ecuației: CH 3 OH + CO → CH 3 COOH
Acest proces folosește acidul hidroiodic ca intermediar și are loc în trei etape. Pentru carbonilare este necesar un catalizator , de obicei un complex metalic (etapa 2).
- CH 3 OH + HI → CH 3 I + H 2 O
- CH 3 I + CO → CH 3 COI
- CH 3 COI + H 2 O → CH 3 COOH + HI
Prin modificarea procesului, anhidrida acetică poate fi produsă de aceeași plantă. Deoarece metanolul și monoxidul de carbon sunt materii prime obișnuite, carbonilarea metanolului a apărut de multă vreme ca o metodă atractivă pentru producerea de acid acetic. Henry Dreyfus din celanezul britanic a dezvoltat o instalație pilot de carbonilare a metanolului încă din 1925. Cu toate acestea, lipsa unui echipament adecvat pentru a conține amestecul de reacție coroziv la presiunile necesare ( 200 atm sau mai mult) a împiedicat comercializarea acestei metode de ceva timp. timp. Primul proces comercializat pentru carbonilarea metanolului, care folosește cobaltul ca catalizator, a fost dezvoltat de compania chimică germană BASF în 1963. În 1968, a fost descoperit un nou catalizator pe bază de rodiu ( cis - [Rh (CO) . 2 I 2 ] - ) capabil să acționeze eficient la presiune scăzută și cu foarte puține subproduse. Prima instalație care utilizează acest catalizator a fost construită de compania americană Monsanto în 1970, iar carbonilarea metanolului catalizat cu rodiu a devenit metoda dominantă de producere a acidului acetic (cunoscut sub numele de procesul Monsanto ). Spre sfârșitul anilor 1990, BP a comercializat catalizatorul Cativa ([Ir (CO) 2 I 2 ] - ), favorizat de ruteniu. Acest proces este mai ecologic și mai eficient decât precedentul și a înlocuit în mare măsură procesul Monsanto, adesea în aceleași fabrici.
Oxidarea acetaldehidei
Inainte de procesul Monsanto a fost comercializat, cel mai acid acetic a fost produs prin oxidarea de acetaldehidă . Această metodă rămâne a doua cale cea mai importantă pentru sinteza acidului acetic, deși nu este competitivă cu carbonilarea metanolului. Acetaldehida poate fi produsă prin oxidarea butanului sau naftei ușoare, oxidarea etilenei sau alternativ prin hidratarea acetilenei .
Când butanul ușor sau nafta sunt încălzite în aer în prezența diferiților ioni metalici, în special mangan , cobalt și crom , se formează un peroxid și apoi se descompune pentru a forma acid acetic: 2 C 4 H 10 + 5 O 2 → 4 CH 3 COOH + 2 H 2 O Lucrăm cu o combinație de temperatură și presiune pentru a avea un amestec de reacție cât mai fierbinte posibil menținând butanul în stare lichidă. Condițiile obișnuite sunt 150 ° C și 55 atm. Se pot forma și mai mulți subproduse, inclusiv butanonă , acetat de etil , acid formic și acid propanoic . Aceste subproduse au, de asemenea, o valoare de piață, iar condițiile de reacție pot fi modificate pentru a produce mai multe dintre ele dacă acest lucru are un avantaj economic. Cu toate acestea, separarea acidului acetic de subprodusele sale se adaugă la costul procesului. Cu condiții și catalizatori similari cu cei utilizați pentru oxidarea butanului, acetaldehida poate fi oxidată de oxigenul din aer pentru a produce acid acetic: 2 CH 3 CHO + O 2 → 2 CH 3 COOH
Datorită catalizatorilor moderni, această reacție poate obține un randament de peste 95%. Principalele subproduse sunt acetat de etil , acid formic și formaldehidă . Toți acești compuși au un punct de fierbere mai scăzut decât acidul acetic și pot fi separați ușor prin distilare .
Oxidarea etilenei
Acetaldehida poate fi preparat din etilena prin procedeul Wacker și apoi oxidat așa cum este detaliat mai sus. Mai recent, o transformare într-un singur pas a etilenei în acid acetic a fost comercializată de compania Shōwa Denkō , care a deschis o instalație de oxidare a etilenei în Oita, Japonia, în 1997. Procesul este catalizat de un catalizator metalic pe bază de paladiu cu ajutorul un heteropoliacid cum ar fi acidul tungstosilicic. Acest proces ar putea concura cu carbonilarea metanolului pentru plantele mici (100-250 kt / an ), în funcție de prețul etilenei.
Sinteza malonică
- Sinteza malonică , folosind halogenometan ca substituent (RX).
Comerț
În 2014, Franța este un importator net de acid acetic, conform obiceiurilor franceze. Prețul mediu de import pe tonă a fost de 430 €.
Variat
Acidul acetic, utilizat local în ORL, face parte din lista de medicamente esențiale a Organizației Mondiale a Sănătății (listă actualizată în aprilie 2013).
Note și referințe
- ACETIC ACID, fișa (datele) de securitate a Programului internațional privind siguranța substanțelor chimice , consultată la 9 mai 2009
- „ACETIC ACID” în Banca de date privind substanțele periculoase , accesat la 16 iulie 2012
- (în) David R. Lide, Manual de chimie și fizică , CRC,16 iunie 2008, 89 th ed. , 2736 p. ( ISBN 142006679X și 978-1420066791 ) , p. 9-50
- (în) Yitzhak Marcus, The Properties of Solvents , vol. 4, Anglia, John Wiley & Sons Ltd,1999, 239 p. ( ISBN 0-471-98369-1 )
- calculate în masă moleculară de „ masele atomice ale elementelor 2007 “ pe www.chem.qmul.ac.uk .
- (en) W. M Haynes, CRC Manual de chimie și fizică , Boca Raton, CRC Press / Taylor și Francis,2011, 91 th ed. , 2610 p. ( ISBN 978-143982-077-3 ) , p. 3-4
- (în) James E. Mark, Physical Properties of Polymer Handbook , Springer,2007, A 2 -a ed. , 1076 p. ( ISBN 0387690026 , citit online ) , p. 294
- (ro) Șerban Moldoveanu, Pregătirea probelor în cromatografie , Elsevier,2002, 930 p. ( ISBN 0444503943 ) , p. 258
- (ro) Robert H. Perry și Donald W. Green , Perry's Chemical Engineers 'Handbook , SUA, McGraw-Hill,1997, A 7- a ed. , 2400 p. ( ISBN 0-07-049841-5 ) , p. 2-50
- Wagner, Frank S. (1978) „Acid acetic”. În: Grayson, Martin (Ed.) , Kirk-Othmer Encyclopedia of Chemical Technology , 3 - lea ediție, New York: Wiley.
- (ro) „Acetic acid” , pe NIST / WebBook , accesat la 28 august 2009
- (în) Carl L. Yaws, Manual de diagrame termodinamice , vol. 1, Huston, Texas, Gulf Pub. Co,1996( ISBN 0-88415-857-8 )
- (în) David R. Lide , Manualul de chimie și fizică al CRC , Boca Raton, CRC Press,18 iunie 2002, 83 th ed. , 2664 p. ( ISBN 0849304830 , prezentare online ) , p. 5-89
- (în) David R. Lide, Manual de chimie și fizică , CRC,2008, 89 th ed. , 2736 p. ( ISBN 978-1-4200-6679-1 ) , p. 10-205
- " Acetic acid " , la www.reciprocalnet.org (accesat la 12 decembrie 2009 )
- Număr index în tabelul 3.1 din apendicele VI la Regulamentul CE nr. 1272/2008 (16 decembrie 2008)
- SIGMA-ALDRICH
- " Acetic acid " în baza de date cu produse chimice Reptox a CSST (organizația din Quebec responsabilă de securitatea și sănătatea în muncă), accesată la 24 aprilie 2009
- (în) „ Acetic acid ” pe ChemIDplus , accesat la 28 august 2009
- „ Acetic acid ” , la hazmap.nlm.nih.gov (accesat la 14 noiembrie 2009 )
- „acid acetic” , pe ESIS , accesat la 3 martie 2010
- „ Acid acetic - Société Chimique de France ” , pe www.societechimiquedefrance.fr (accesat la 10 octombrie 2020 )
- INRS, fișă toxicologică , prospect 8 pp Ref FT 24, versiunea 2019
- Temperatura de topire este în jur de 16,6 ° C . Punctul său de fierbere este puțin mai mic decât 117,9 ° C . Produsul este inflamabil , cu un punct de aprindere sub 40 ° C , în timp ce temperatura de autoaprindere se ridică la 465 ° C .
- Khelifi, L., Ghorbel, A., Garbowski, E. și Primet, M. (1997). Pregătirea sol-gel a catalizatorilor Pt / Al2O3 pentru arderea catalitică. Jurnalul de chimie fizică , 94, 2016-2026.
- Rezgui, S., Ghorbel, A. și Gates, BC (1995). Controlul preparării catalizatorilor de oxid mixt de crom și aluminiu prin procedee sol-gel . Jurnalul de chimie fizică, 92, 1576-1588 | rezumat .
- Barbara Brutsaert, „ Acizi organici și acizi grași cu lanț mediu ”, producția de porci și păsări de curte ,2009( citește online )
- Pierre de Menten , dicționar chimiei: O abordare etimologică și istorică , De Boeck,2013, 395 p. ( ISBN 978-2-8041-8175-8 , citit online ) , p.20
- Goldwhite, Harold (2003). Sectă New Haven. Taur. Am. Chem. Soc. (Septembrie 2003) .
- Martin, Geoffrey (1917). Chimie industrială și industrială , partea 1, organică. Londra, Crosby Lockwood, p. 330–31 .
- Schweppe, Helmut (1979). „Identificarea coloranților pe textile vechi” . J. Am. Inst. Conservarea 19 (1/3), 14-23.
- Jones, RE; Templeton, DH (1958). „Structura cristalină a acidului acetic”. Acta Crystallogr. 11 (7), 484-87.
- J. Chen, CL Brooks și H. Sherega, „Revizitarea dimerilor de acid carboxilic în soluție apoasă”, J. Phys. Chem. B , vol. 112, paginile 242-249, 2008.
- Lafon-Lafourcade, S., Lucmaret, V. și Joyeux, A. (1980). Câteva observații privind formarea acidului acetic de către bacteriile lactice. OENO One, 14 (3), 183-194 | rezumat .
- Dicționar de compuși organici ( Ed. A 6- a) , Vol. 1 (1996). Londra: Chapman & Hall. ( ISBN 978-0-412-54090-5 )
- Yoneda, Noriyki; Kusano, Satoru; Yasui, Makoto; Pujado, Peter; Wilcher, Steve (2001). Aplic. Catal. A: Gen. 221 , 253–265.
- „Raport de producție”. Chem. Eng. Știri (11 iulie 2005), 67-76.
- Suresh, Bala (2003). „Acid acetic” . Raport CEH 602.5000, SRI International.
- Lancaster, Mike (2002) Green Chemistry, an Introductory Text , Cambridge, Royal Society of Chemistry, p. 262–266 . ( ISBN 978-0-85404-620-1 ) .
- Sano, Ken-ichi; Uchida, Hiroshi; Wakabayashi, Syoichirou (1999). Sondaje de catalizatori din Japonia 3 , 55-60.
- „ Indicator al comerțului de import / export ” , la Direcția Generală a Vămilor. Indicați NC8 = 29152100 (accesat la 7 august 2015 )
- Lista model OMS a medicamentelor esențiale, lista 18 , aprilie 2013
Bibliografie
- Avom, J., Mbadcam, JK, Matip, MRL și Germain, P. (2001). Adsorbția izotermă a acidului acetic de către carbon de origine vegetală . Revista Africană de Știință și Tehnologie, 2 (2).
- Brodzki, D., Denise, B. și Pannetier, G. (1977). Proprietăți catalitice ale complexelor de metale prețioase: carbonilarea metanolului în acid acetic în prezența compușilor iridiu (I). Journal of Molecular Catalysis, 2 (3), 149-161.
- Pastor L (1862). Noul proces industrial pentru fabricarea oțetului . Mallet-Bachelier.