Gliceraldehidă-3-fosfat dehidrogenază
Dehidrogenaza gliceraldehid 3-fosfat ( GAPDH ) este o oxidoreductaza care catalizează reacția :

|
+ NAD + + Pi NADH + H + + |
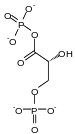
|
| Gliceraldehidă-3-fosfat | 1,3-Bifosfoglicerat |
Această enzimă este implicată în etapa a șasea a glicolizei , prin urmare , în degradarea de glucoză , care eliberează energie metabolică și puterea de reducere sub formă de ATP și NADH + H + , respectiv . Pe lângă această funcție metabolică esențială, s-a știut recent că GAPDH este implicat în mai multe procese non-metabolice, cum ar fi activarea transcripției , inițierea apoptozei și transferul veziculelor între reticulul endoplasmatic și aparatul Golgi .
Gliceraldehidă-3-fosfat dehidrogenază| CE nr. | CE |
|---|---|
| numar CAS |
| IUBMB | Intrare IUBMB |
|---|---|
| IntEnz | Vizualizare IntEnz |
| BRENDA | Intrarea BRENDA |
| KEGG | Intrare KEGG |
| MetaCyc | Calea metabolică |
| PRIAM | Profil |
| PDB | Structuri |
| MERGE | AmiGO / EGO |
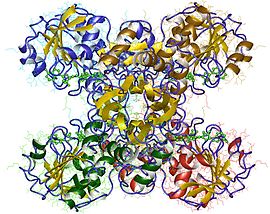
 GAPDH de la Thermus aquaticus ( PDB 1CER )
GAPDH de la Thermus aquaticus ( PDB 1CER )
| Pfam | PF00044 |
|---|---|
| Clanul Pfam | CL0063 |
| InterPro | IPR020828 |
| PROSITATE | PDOC00069 |
| SCOP | 1gd1 |
| SUPERFAMILIE | 1gd1 |
 Pyrococcus horikoshii GAPDH ( PDB 2CZC )
Pyrococcus horikoshii GAPDH ( PDB 2CZC )
| Pfam | PF02800 |
|---|---|
| Clanul Pfam | CL0139 |
| InterPro | IPR020829 |
| PROSITATE | PDOC00069 |
| SCOP | 1gd1 |
| SUPERFAMILIE | 1gd1 |
Funcția metabolică
GAPDH catalizează singura reacție de oxidare a glicolizei; se referă la funcția aldehidă a gliceraldehidei-3-fosfatului (GAP) și produce un acil-fosfat, 1,3-bifosfoglicerat . Reacția de oxidare este cuplată cu transferul unui fosfat anorganic pe molecula GAP și reducerea unui NAD + la NADH + H + .
GAPDH catalizează, de asemenea, reacția inversă atunci când gluconeogeneza predomină asupra glicolizei.
Mecanismul catalitic al GAPDH constă în două etape:
- Reacție de oxidare-reducere
- Fosforilarea
Pentru o schemă a mecanismului de reacție al GAPDH , din Molecular Cell Biology , Lodish, H, (200) ediția a IV-a. WH Freeman.
Reacția catalizată GAPDH ilustrează modul în care energia eliberată într-o reacție de oxidare este utilizată pentru a produce un compus cu o legătură de potențial energetic ridicat. Este o cuplare energetică printr-un mecanism de transfer de energie între o reacție de oxidare exergonică și o reacție de fosforilare a unui substrat endergonic . În etapa următoare a glicolizei (etapa 7), energia transferată în acidul 1,3-bisfosfogliceric va fi utilizată pentru a produce o moleculă de ATP.
Caracteristici structurale
GAPDH este un homotetramer ale cărui subunități au o masă moleculară cuprinsă între 34 și 38 kDa . O subunitate este formată din aproximativ 330 de aminoacizi care se pliază împreună pentru a forma două domenii. Primul domeniu este implicat în legarea cofactorului (NAD + ): fiecare dintre subunități leagă deci o moleculă de NAD + . Al doilea domeniu este implicat în legarea substratului și în cataliză: acest domeniu conține cisteină 149 și histidină 176, două reziduuri esențiale pentru mecanismul catalitic.
Localizare celulară
Toate reacțiile de glicoliză care au loc în citosol , GAPDH este o enzimă citosolică. Cu toate acestea, studiile asupra membranei plasmatice a celulelor roșii din sânge au arătat că anumite enzime ale glicolizei, aldolazei , fosfofructokinazei și GAPDH, se leagă în mod specific și reversibil de partea citoplasmatică a benzii proteice a membranei 3 (canalul anionic).
Funcții nemetabolice
GAPDH este adesea utilizat în experimente, pentru a standardiza rezultatele obținute pentru alte proteine celulare. Exemple: qPCR, WB etc.
Celelalte clase de GAPDH
În plus față de GAPDH descris mai sus, există alte două clase de GAPDH care diferă de cea anterioară prin funcția lor enzimatică, localizarea lor celulară și specificitatea lor față de cofactor, NAD sau NADP.
- GAPDH cloroplastic ( EC ), găsit în mod specific în cloroplastele organismelor fotosintetice în care acestea sunt implicate în ciclul Calvin . Această clasă de GAPDH are o preferință pentru NADP + , în concordanță cu implicarea sa într-o cale anabolică . Enzimele din această clasă catalizează defosforilarea reductivă a 1,3-DPG la G3P în paralel cu oxidarea unei molecule NADPH.
- GADPH non-fosforilant ( EC ), citosolic, care catalizează oxidarea ireversibilă a G3P la 1-3 Bifosfoglicerat în prezența NADP + și a unei molecule de apă.
Note și referințe
- Valorile pentru masa și numărul de resturi indicate aici sunt cele ale precursorului de proteină care rezultă din traducerea a genei , inainte de modificări post-translaționale și pot diferi în mod semnificativ de valorile corespunzătoare pentru proteina funcțională.
- S. Moniot și colab., „ Prinderea intermediarului tioacilgliceraldehidă -3-fosfat dehidrogenază din B.stearothermophilus ”, JBC , vol. 283,2008, p. 21683-21702 ( citiți online )
- G. Ferri, G. Comerio, P. Ladarola, MC Zapponi, ML Speranza, „ Structura subunității și activitatea gliceraldehidei-3-fosfat dehidrogenazei din cloroplastele sinachice ”, Biochem Biophys Acta. , vol. 522, n o 1,1978, p. 19-31.
- AA Iglesias și M. Losada, „ Purificarea și proprietățile cinetice și structurale ale spanacului leef NADP-dependent de fosforilare gliceraldehidă-3-fosfat dehidrogenază ”, Arch Biochem Biophys. , vol. 260, n o 21988, p. 830-40.
Referințe bibliografice
- (ro) Biochimie generală , JH Weil (1990), ediția a șasea. Masson.
- (ro) Biologia moleculară a celulei , B. Alberts și colab. (2002), ediția a patra. Știința ghirlandei.
- (ro) Biochimie , JG Voet, D. Voet (1995), ediția a doua. John Wiley & sons, Inc.