Acid piruvic
| Acid piruvic | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
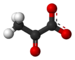
  Structura acidului piruvic |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificare | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Numele IUPAC | Acid 2-oxopropanoic | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sinonime |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o ECHA | 100.004.387 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o EC | 204-824-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 1060 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| FEMA | 2970 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ZÂMBETE |
CC (= O) C (= O) O , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
Std. InChI: InChI = 1S / C3H4O3 / c1-2 (4) 3 (5) 6 / h1H3, (H, 5,6) Std. InChIKey: LCTONWCANYUPML-UHFFFAOYSA-N |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspect | lichid incolor | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietăți chimice | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Formula brută |
C 3 H 4 O 3 [Izomeri] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masă molară | 88,0621 ± 0,0036 g / mol C 40,92%, H 4,58%, O 54,5%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| pKa | 2.4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietăți fizice | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fuziune | 12 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fierbere | 165 ° C (descompunere) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solubilitate | solubil în etanol și eter | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscibilitate | miscibil in apa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa volumică | 1,27 g · cm -3 până la 20 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punct de aprindere | 82 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termochimie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C p |
ecuaţie:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Precauții | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Pericol H314, P280, P301 + P330 + P331, P305 + P351 + P338, P309 + P310, H314 : Provoacă arsuri severe ale pielii și leziuni oculare P280 : Purtați mănuși de protecție / îmbrăcăminte de protecție / protecție a ochilor / protecție a feței. P301 + P330 + P331 : În caz de înghițire: clătiți gura. Nu provocați voma. P305 + P351 + P338 : Dacă este în ochi: Clătiți cu atenție cu apă timp de câteva minute. Scoateți lentilele de contact dacă victima le poartă și acestea pot fi îndepărtate cu ușurință. Continuați să clătiți. P309 + P311 : Dacă este expus sau vă simțiți rău: sunați imediat la un CENTRU DE TOXICOLOGIE sau la un medic / medic. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  B3, E, B3 : Punct de aprindere lichid combustibil = 83,8 ° C cupă închisă Metoda Setaflash E : Material puternic acid coroziv (pH calculat = 1,8 pentru o soluție 0,1 M) Dezvăluire la 1,0% conform criteriilor de clasificare |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transport | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
80 : coroziv sau care prezintă un grad minor de corozivitate Număr ONU : 3265 : LICHID COROSIV, ACID, ORGANIC, NSA Clasa: 8 Etichetă: 8 : Substanțe corozive Ambalare: Grupa de ambalare III : substanțe cu pericol scăzut.  |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ecotoxicologie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DL 50 | șoarece, subdermic: 3533 mg · kg -1 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Compuși înrudiți | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Alți compuși | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unități de SI și STP, cu excepția cazului în care se prevede altfel. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Acidul piruvic este un compus chimic cu formula CH 3 CO-COOH. Este un acid 2-oxo sau α- cetoacid , purtând atât o funcție acid carboxilic, cât și o cetonă funcțională . Baza sa conjugată este anionul piruvat CH 3 -CO-COO -, O cheie de metabolit situat la intersecția mai multor importante căi metabolice în celulele vii , cum ar fi glicoliza , ciclul Krebs și gluconeogenezei și pot fi transformați în acizi grași , alanină sau chiar etanol după decarboxilare oxidativă în acetil-coenzima A .
Acid piruvic
Acidul piruvic apare ca un lichid incolor, asemănător în miros cu acidul acetic . Este miscibil în apă și solubil în etanol și eter .
In laborator, acidul piruvic poate fi preparat prin încălzirea unui amestec de acid tartric și bisulfat de potasiu , prin oxidarea de propilenglicol cu un oxidant puternic ( de exemplu , permanganat de potasiu sau de hipoclorit de sodiu ), sau din nou , prin hidroliza 2-oxopropiononitril , formată prin reacția de clorură de etanoil cu cianură de potasiu :
CH 3 COCl + KCN → CH 3 COCN CH 3 COCN → CH 3 COCOOHBiochimia piruvatului
Descriere
Ionul piruvat este produsul final al căilor de degradare a glucozei ( glicoliză , calea pentozei fosfat , calea Entner-Doudoroff ). Este substratul unei fermentații în starea anaerobă (fermentație lactică), iar ciclul Krebs este furnizat indirect de aerob după decarboxilarea oxidativă, transformându-l în acetil-CoA .
Formarea piruvatului prin glicoliză

|
+ ADP + H + ATP + |

|
| PEP | Acid piruvic | |
| kinaza - EC | ||
Fosfoenolpiruvat (PEP) format în timpul glicolizei are un fosfat de grup , cu un potențial ridicat de transfer - AG ° ' = -61.9 kJ mol -1 , cea mai mare valoare măsurată în ființe vii - permițând fosforilarea unei molecule de ADP în ATP prin piruvat kinaza . Un Mg 2+ cation este necesară pentru această reacție ca cofactor .
Soarta piruvatului în anaerobioză
Următoarele reacții au loc, în anaerob mediu , în citoplasmă , în mușchi , în acid lactic bacterii (pentru fermentație lactică , de exemplu în lactobacillus ), sau chiar și în drojdie (pentru fermentație alcoolică ). Sunt posibile alte fermentații , de exemplu în Enterobacteriaceae (cf. căi de fermentație ale Enterobacteriaceae ).
Fermentarea lactică

|
+ NADH + H + → NAD + + |

|
| Acid piruvic | Acid lactic | |
| L- lactat dehidrogenază - CE | ||
CH 3 -CHOH-COO - lactatprodus în mușchi nu este responsabil pentru rigiditate , contrar credinței populare, și nu intervine în fenomenul crampelor . În plus, poate fi transportat în sânge și apoi în celulele hepatice ( ciclul Cory ).
Fermentarea alcoolică- CH 3 -CO-COO -+ H + → CH 3 CHO+ CO 2, prin piruvat decarboxilază , în prezența tiaminei pirofosfat (TPP).
- CH 3 CHO+ NADH + H + CH 3 CH 2 OH + NAD + , prin alcool dehidrogenază .
Soarta piruvatului în aerobioză
Într-un mediu aerob , piruvatul este degradat în mitocondrii . Intră prin translocaza piruvat . Sunt posibile două reacții, care generează precursorii ciclului Krebs :
Decarboxilarea oxidativă la acetil-CoAAceastă reacție este catalizată de un complex multienzimatic, complexul piruvat dehidrogenază , care implică cinci coenzime :
- trei coenzime legate de apoenzime : TPP , lipoat și FAD (acestea sunt grupuri protetice );

|
+ NAD + + CoA-SH → CO 2+ NADH + H + + |
|
| Acid piruvic | Acetil-CoA | |
|
Complex piruvat dehidrogenază : piruvat dehidrogenază (E1) - EC dihidrolipoamidă S-acetiltransferază (E2) - EC dihidrolipoil dehidrogenază (E3) - EC | ||
Această reacție are loc la nivelul peretelui mitocondrial pentru eucariote și la nivelul membranei pentru procariote .
NADH + H + va reoxidized ulterior de lanțul respirator , lanțul sinonim de transport de electroni mitocondrial, pentru a genera ATP aerobioză.
Carboxilarea la oxaloacetatReacția, catalizată în prezența biotinei de piruvat carboxilaza ( sintetaza ), produce oxaloacetat :

|
+ ATP + CO 2 → ADP + Pi + |
|
| Acid piruvic | Acid oxaloacetic | |
| Piruvat carboxilaza - EC | ||
Aceasta este o reacție anaplerotică majoră.
Eficiență energetică comparativă
Dintr-o moleculă de glucoză , care dă două molecule de piruvat:
- fermentațiile au un randament mediocru: eliberează doar două molecule de ATP per moleculă de glucoză;
- degradările aerobe sunt mult mai profitabile: fiecare moleculă de glucoză permite producerea a 14 molecule de ATP prin decarboxilare oxidativă sau 6 molecule de ATP prin carboxilare, chiar înainte de degradarea acetil-CoA de către ciclul de Krebs care eliberează și mai multă energie.
Note și referințe
- calculate în masă moleculară de „ masele atomice ale elementelor 2007 “ pe www.chem.qmul.ac.uk .
- Introducerea numărului CAS "127-17-3" în baza de date chimice GESTIS a IFA (organism german responsabil cu securitatea și sănătatea în muncă) ( germană , engleză ), acces 03/08/09 (JavaScript necesar)
- (în) Carl L. Yaws, Manual de diagrame termodinamice , vol. 1, Huston, Texas, Gulf Pub. Co,1996( ISBN 0-88415-857-8 )
- Intrarea „Acid piruvic” în baza de date chimice GESTIS a IFA (organism german responsabil cu securitatea și sănătatea în muncă) ( germană , engleză ), accesat la 6 ianuarie 2019 (este necesar JavaScript)
- „ Acid piruvic ” în baza de date a substanțelor chimice Reptox a CSST (organizația din Quebec responsabilă de securitatea și sănătatea în muncă), accesată la 24 aprilie 2009
- Sinteze organice, col. Zbor. 1, p. 475 (1941); Zbor. 4, p. 63 (1925). [1]
- Wienek, Sport Biology , p. 256, Vigot