Mezoteliom
Mezoteliom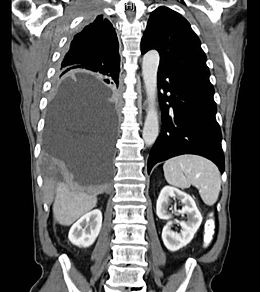 Tomografie toracică care arată mezoteliom în plămânul drept (stânga în imagine).
Tomografie toracică care arată mezoteliom în plămânul drept (stânga în imagine).
| Specialitate | Oncologie |
|---|
| CISP - 2 | R84 |
|---|---|
| ICD - 10 | C45 |
| CIM - 9 | 163 |
| ICD-O | M 9050/3 -9055 |
| OMIM | 156240 |
| BoliDB | 8074 |
| MedlinePlus | 000115 |
| eMedicină | 280367 |
| eMedicină | med / 1457 |
| Plasă | D008654 |
| Simptome | Sibilanță , dispnee , dureri toracice , revărsat pleural , scădere în greutate și tuse uscată ( d ) |
Mezoteliom este o forma rara si virulenta de cancer a suprafețelor mezoteliale care afectează mucoasa plămânilor ( pleurei ), cavitatea abdominală ( peritoneal ) sau carcasa inimii (The pericard ). Mezoteliomul pulmonar este cauzat de expunerea la fibre minerale (cum ar fi azbestul sau erionita ).
Studiile actuale fac posibilă afirmarea fără echivoc ( raportul de șanse de 6,6 și riscul relativ de 5,02) o relație între expunerea la azbest și dezvoltarea mezoteliomului peritoneal.
Unele persoane au fost expuse la acesta la locul de muncă, în timp ce altele au fost expuse în mod secundar de către membrii familiei care, fără să vrea, au adus fibre acasă de la locul de muncă în hainele sau părul sau pe pielea lor .
Mezoteliomul este o boală care trebuie notificată în Franța , profesioniștii din domeniul sănătății trebuie să o raporteze medicului de la Agenția Regională de Sănătate .
Mezoteliom pulmonar
Definiție
Apariția acestei boli, denumită uneori „cancerul azbestului ”, această fibră fiind principalul factor de risc recunoscut pentru acest tip de cancer, nu este indicativă a unui prag minim de expunere și tratamentul său medical are un impact limitat asupra vieții. speranța pacienților.
Primele manifestări constatate la examenul clinic sunt durerile toracice, adesea asociate cu dificultăți de respirație și revărsat pleural recurent, de obicei hemoragic. Timpul de latență dintre prima expunere și dezvoltarea mezoteliomului este rareori mai mic de 20 de ani, adesea de ordinul 30-40 de ani sau chiar mai mult. Nu pare să existe o valoare de prag de expunere legată de un risc de apariție.
Au fost descrise cazuri de mezoteliom pleural, care apar în mediul familial apropiat de lucrătorii expuși la azbest, subiecții fiind expuși din cauza contaminării locuințelor sau în timpul întreținerii hainelor prăfuite.
Tutunul nu pare să crească riscul de apariție a mezoteliom , atunci când acesta este un factor de risc suplimentar pentru cancerul pulmonar (CBP).
semne si simptome
Diagnostic
Câteva cuvinte cheie: radiografie toracică , teste funcționale pulmonare , scanare CT (sau scanare CAT) sau citologie RMN dacă există mult lichid, biopsie trans-toracică , histopatologie , toracoscopie , laparoscopie
| Pozitiv | Negativ |
| EMA ( antigenul membranei epiteliale = antigenul membranei epiteliale ) | CEA ( antigen carcinoembrionar ) |
| WT1 (tumora Wilms 1) | B72.3 |
| Calretinina | MOC-3 1 |
| Mesotelină-1 | CD15 |
| Citokeratina 5/6 | Ber-EP4 |
| HBME-1 ( celula mezotelială umană 1 = celula mezotelială umană 1 ) | TTF-1 |
Teste de orientare
Nu există un protocol universal acceptat pentru screening-ul persoanelor care au fost expuse la azbest. Cu toate acestea, unele cercetări indică faptul că nivelul osteopontinei din ser este util în screeningul mezoteliomului la persoanele expuse. Nivelul proteinei solubile legate de mezotelină este crescut în ser la aproximativ 75% dintre pacienții al căror diagnostic a fost confirmat și s-a sugerat că ar putea fi utilă pentru screening. Testul mezotelinei în sine, în sânge, ar fi specific, dar nu foarte sensibil. Fibulin-3 ar fi un marker promițătoare atât testul de sânge decât în pleură.
Revizuire și evaluare
Odată confirmat diagnosticul, medicul va trebui să evalueze gradul patologic al tumorii pentru a stabili o strategie de tratament terapeutic. Mezoteliomul este descris ca localizat dacă cancerul se găsește numai pe suprafața membranei pleurale de unde a început. Este clasificat ca avansat dacă există o extensie dincolo de suprafața inițială a pleurei la alte părți ale corpului, cum ar fi ganglionii limfatici, plămânii, peretele toracic sau organele abdominale.
Fiziopatologie
Mesothelium constă dintr - un singur strat, subțire de celule cubice care formează un epiteliu captuseala cavitatile seroase corpului , inclusiv peritoneu , pericard, și pleura pentru a forma o cavitate virtuală. Depunerea fibrelor minerale în parenchimul pulmonar poate duce la pătrunderea lor în pleura viscerală de unde fibra poate ajunge apoi la suprafața pleurală și, astfel, poate duce la dezvoltarea plăcilor mezoteliale maligne. Procesul care duce la dezvoltarea mezoteliomului peritoneal nu este încă cunoscut. S-a sugerat că fibrele de azbest din plămâni ar putea fi transportate către abdomen și organele asociate prin sistemul limfatic . În plus, fibrele minerale pot fi depuse în intestin după ingestia de spută contaminată.
S-a demonstrat că contaminarea pleurei cu azbest sau alte fibre minerale induce carcinogeneza. Fibrele lungi și subțiri de azbest (azbest albastru, amfiboli ) sunt agenți cancerigeni mai eficienți decât „fibrele cu pene” din crizotil (sau azbestul alb). La șobolani dezvoltarea mezoteliomului a fost cauzată de inocularea intrapleurală a fibrelor fosforilate de crizotil. S-a sugerat că la om, transportul fibrelor către pleură este etapa critică în patogeneza mezoteliomului. Această ipoteză este susținută de afluxul observat al unui număr semnificativ de macrofage și alte celule ale sistemului imunitar la leziunile localizate cauzate de fibrele de azbest acumulate în cavitățile pleurale și peritoneale ale șobolanilor. Aceste leziuni continuă să atragă macrofage în număr mare pe măsură ce boala progresează, iar modificările celulare din leziune duc la o tumoare a cărei morfologie are toate caracteristicile maligne.
Experimentarea sugerează în mod clar că azbestul acționează ca un cancerigen complet în dezvoltarea mezoteliomului care apare în etape secvențiale de inițiere și promovare. Mecanismele moleculare care stau la baza transformării maligne a celulelor mezoteliale normale în prezența fibrelor de azbest rămân destul de obscure, în ciuda demonstrației posibilităților oncogene ale substanței. Cu toate acestea, transformarea in vitro a celulelor mezoteliale umane normale în celule cu fenotip malign după expunerea la fibre de azbest nu a fost încă efectuată. În general, se crede că fibrele de azbest își exercită efectul cancerigen prin interacțiuni fizice directe cu celulele mezoteliului împreună cu efecte indirecte cu interacțiunea cu celule inflamatorii, cum ar fi macrofagele. Studiile care implică inocularea intrapleurală sau intraperitoneală a diferitelor tipuri de fibre de azbest la șobolani și șoareci au stabilit că fibrele lungi și subțiri sunt responsabile de o incidență mai mare a mezoteliomului decât fibrele scurte și că celulele fagocitează și stochează fibrele mai lungi mai eficient decât fibrele scurte. La fel, incubația celulelor de hamster sirian cu fibră de sticlă, a cărei lungime medie a fost de 9,5 µm , a provocat transformări celulare cu o rată identică cu cea a crocidolitului . Reducerea lungimii acestor fibre la o dimensiune aproximativă de 2,2 µm a redus capacitatea de transformare a celulei cu un factor de 10 până la 20, în timp ce reducerea suplimentară la mai puțin de 1 µm a suprimat complet capacitatea de transformare a celulei de către particulele din fibră de sticlă.
Analiza interacțiunilor dintre fibrele de azbest și ADN a arătat că fibrele fagocitate pot intra în contact cu cromozomii , fibrele aderă adesea la cromatină sau se pot încurca în cromozom. Acest contact dintre fibra de azbest și proteinele structurale ale dublei spirale ale cromozomului poate induce anomalii complexe. Cea mai anomalie comună este monosomy a cromozomului 22 . Alte anomalii comune includ rearanjarea structurii brațele unuia res , 3 - lea , 6 - lea și 9 - lea perechi de cromozomi.
Cele mai frecvente anomalii genetice ale liniilor celulare ale mezoteliomului includ ștergerea următoarelor gene supresoare tumorale :
- neurofibromatoza tip 2 la 22q12
- p16 INK4A
- p14 ARF (ro)
S-a demonstrat că azbestul mediază intrarea ADN - ului străin în celulele țintă. Incorporarea acestui ADN străin poate provoca mutații și poate duce la oncogeneză prin mai multe mecanisme posibile:
- inactivarea genelor supresoare tumorale;
- activarea genelor oncogene ;
- activarea proto-oncogenelor datorită încorporării ADN-ului străin care conține o genă promotor ;
- activarea enzimelor reparatoare ale ADN-ului , care pot fi predispuse la erori;
- activarea telomerazei ;
- prevenirea apoptozei .
S-a demonstrat că fibrele de azbest schimbă funcția și proprietățile secretoare ale macrofagelor, creând în cele din urmă condiții care favorizează dezvoltarea mezoteliomului. După înghițirea fibrelor de azbest, macrofagele produc cantități crescute de radicali hidroxil, care sunt produse secundare normale ale metabolismului celular anaerob. Cu toate acestea, acești radicali liberi sunt, de asemenea, cunoscuți sub numele de clastogen și, de asemenea, agenți care au o acțiune asupra membranei pentru a promova efectul cancerigen al azbestului. Acești oxidanți pot participa la procesul oncogen direct și indirect acționând asupra ADN-ului , modificând membrana celulară prin diferite mecanisme, inclusiv activarea oncogenelor și întreruperea apărării antioxidante celulare. Azbestul poate avea și proprietăți imunosupresoare . De exemplu, s-a arătat că fibrele crizotile scad proliferarea in vitro a limfocitelor periferice stimulate de fitohemaglutinine, suprimă liza celulelor naturale ucigașe și reduc semnificativ viabilitatea și rotația celulelor ucigașe activate de limfokine (in) . În plus, modificările genetice ale macrofagelor activate de azbest pot duce la producerea de substanțe mitogene eficiente pe celulele mezoteliale, cum ar fi factorul de creștere derivat din trombocite (in) ( PDGF (in) ) și factorul de creștere transformator - β ( TGF-β (en ) ) care la rândul său poate induce stimularea cronică și proliferarea celulelor mezoteliale după leziunile cauzate de fibrele de azbest.
Epidemiologie
ImpactRatele de incidență au crescut în ultimii 20 de ani , Dar mezoteliomul rămâne un cancer relativ rar (aproximativ un caz pe milion de persoane; prin comparație, populațiile cu un nivel ridicat de fumat pot ajunge la incidența a peste o mie de cancer pulmonar pe milion locuitori).
Incidența mezoteliomului malign atinge în prezent un nivel de aproximativ 7 până la 40 de cazuri la 1.000.000 de locuitori în țările industrializate din vest, în funcție de gradul de expunere a populațiilor la azbest în ultimele decenii. S-a estimat că incidența în Statele Unite ar fi putut ajunge la una până la 15 la 1.000.000 de populații în 2004. Incidența se așteaptă să crească în continuare în alte părți ale lumii. Mezoteliomul apare mai des la bărbați decât la femei și riscul crește odată cu vârsta, dar boala poate apărea la bărbați sau femei la orice vârstă. Aproximativ o cincime până la o treime din toate mezotelioamele sunt tumori peritoneale.
Se poate observa că o epidemie de mezoteliom a fost descoperită în trei sate turcești (Karain, Tuzkoy și Sarehidir) situate în Capadocia . Ea este responsabilă astăzi 50% din decesele de acolo.
În Franța, în 2014 , un raport HCSP bazat pe datele InVS a estimat că din 100.000 de decese de azbest așteptate din 2009 până în 2050 (50.000 până la 75.000 vor fi cauzate de cancer pulmonar și 18.000 până la 25.000 au mezoteliom. Și conform InVS 61.000 până la 118.000 decesele au fost deja cauzate de azbest între 1995 și 2009, inclusiv 25.000 până la 36.000 din cauza mezoteliomului (pentru 36.000 până la 82.000 din cauza cancerului pulmonar profesional) Andeva (asociația națională pentru apărarea victimelor azbestului) solicită reducerea pragului la 0,5 fibre pe litru de aer în loc de pragul de 5 fibre pe litru de aer pentru îndepărtarea sau conținerea azbestului din clădiri.
Factori de riscExpunerea profesională la azbest este principalul factor de risc pentru mezoteliom. Un istoric al expunerii la azbest există în aproape toate cazurile enumerate. Cu toate acestea, mezoteliomul a fost raportat la câteva cazuri de persoane fără expunere cunoscută la azbest.
Azbestul este denumirea unui grup de minerale care apar în mod natural ca aglomerat de fibre dure și flexibile care pot fi separate în fire subțiri și țesute împreună. Azbestul a fost utilizat pe scară largă în multe produse industriale, inclusiv ciment, căptușeli de frână, șindrilă pentru acoperiș, podele, textile și produse de izolare. Dacă particule minuscule de azbest plutesc în aer, în special în timpul procesului de fabricație, acestea pot fi inhalate sau înghițite și pot provoca probleme grave de sănătate. Pe lângă mezoteliom, expunerea la azbest crește riscul de cancer pulmonar , provoacă azbestoză, fibroză pulmonară (boală cronică necanceroasă) și alte tipuri de cancer, cum ar fi tumorile laringelui și ale rinichilor. Pentru o persoană, combinația de fumat și expunerea la azbest crește semnificativ riscul de a dezvolta cancer al căilor respiratorii superioare sau carcinom bronșic . Marca Kent a folosit azbest în filtrele sale de țigări în primii ani de producție din anii 1950 și au rezultat câteva cazuri de mezoteliom. În afară de acest caz particular, fumatul nu pare să crească riscul de mezoteliom. Câteva studii sugerează că virusul simian 40 ( SV40 ) poate acționa ca un cofactor în dezvoltarea mezoteliomului.
Expunerea la azbestSectoarele profesionale care au condus la expunerea la azbest au vizat unitățile de extracție și industriile care utilizează azbest datorită proprietăților sale:
- unități de extracție (mine și mori, pentru a prepara fibre de un anumit calibru),
- fabricarea materialelor pe bază de azbest: fabricarea fibrocimentului, a materialelor textile din azbest , materiale de frecare (frâne, ambreiaje),
- izolarea (în clădiri, în fabricarea cuptoarelor industriale, în fabricarea de echipamente termice și frigorifice, în șantierele navale) și izolarea termică (flocarea cu produse care conțin azbest a fost interzisă în Franța din 1997),
- utilizarea azbestului ca protecție împotriva căldurii (mănuși, șorțuri, șnururi, pături etc.) în diverse industrii: șantiere navale, siderurgie , turnătorie , fabricarea sticlei , industria construcțiilor etc.
De la interzicerea fabricării importului și comercializării materialelor care conțin azbest în Franța (Decretul 96-1133 din 24.12.1996), intervenția asupra materialelor existente care conțin azbest este principala preocupare, în special în rândul tuturor profesioniștilor din construcții (lucrări de îndepărtare a azbestului).
- (fr) Ghid pentru identificarea expunerii la azbest [PDF] , Société de pneumologie de langue française
În 2011, șase regiuni din Franța au fost supuse notificării obligatorii a mezoteliomului, ca parte a supravegherii epidemiologice a InVS și a planului pentru cancer 2009-2013 Aquitaine, Auvergne, Île-de-France (Val-de-Marne și Seine-Saint -Denis), Lorena, Midi-Pirinei, Provence-Alpi-Coasta de Azur (Alpes-Maritimes, Bouches-du-Rhône, Var). 1.090 de decese au fost estimate din cauza mezoteliomului pleural malign în 2005. Pentru 80% s-a găsit expunere la fibre de azbest și aproape 70% erau bărbați. Azbestul este încă responsabil pentru 10-20% din cancerul pulmonar și ar putea provoca 100.000 de decese până în 2025, potrivit datelor de la fosta Agenție pentru Mediu și Sănătate (Afsset). Din 2002, Fondul de compensare a victimelor azbestului (Fiva) a plătit aproape 2,4 miliarde de euro către aproximativ 52.000 de victime.
Tratament
Tratamentul mezoteliomului cu terapii convenționale nu s-a dovedit eficient și pacienții au un timp mediu de supraviețuire de 6 până la 12 luni după diagnostic. În cele mai bune cazuri (cei care pot beneficia de o vindecare chirurgicală prelungită), poate ajunge la 20 de luni. Gradul de malignitate al tumorii depinde de mai mulți factori, inclusiv suprafața mezotelială totală a cavității pleurale, a cărei importanță favorizează metastazele locale prin celulele exfoliate, precum și invazia țesuturilor subiacente și a altor organe din cavitatea pleurală. Un alt factor implicat este perioada de latență extrem de lungă dintre expunerea la azbest și dezvoltarea bolii.
Interventie chirurgicalaExistă două tipuri de intervenții chirurgicale. Pleurectomia parțială mai ușoară și pleurotectomia mărită care implică îndepărtarea pleurei și a unui bloc pulmonar. În unele cazuri, intervenția chirurgicală poate crește semnificativ speranța de supraviețuire (încă cinci până la nouă săptămâni peste supraviețuirea mediană).
ChimioterapieCombinația dintre pemetrexed și cisplatină este mai bună decât cisplatina în monoterapie, ceea ce la rândul său permiteFebruarie 2004, aprobarea de către Administrația pentru Alimente și Medicamente a utilizării sale. Utilizarea acestui medicament este permisă în Franța din 2005. Raltitrexedul (în) are o eficacitate comparabilă. Adăugarea de bevacizumab la chimioterapie (gemcitabină + cisplatină) se dovedește a fi dezamăgitoare. Bevacizumab in asociere cu chimioterapia standard (pemetrexed + cisplatină) conduce la o îmbunătățire a supraviețuirii.
ImunoterapieRegimurile terapeutice care implică tratamentul cu imunoterapie au dat rezultate variabile. De exemplu, s-a demonstrat că inocularea intrapleurală a Bacillus Calmette-Guérin (BCG) în încercarea de a amplifica răspunsul imun nu oferă niciun beneficiu pacientului (în timp ce poate îmbunătăți starea pacienților cu cancer de vezică urinară ). Celulele mezoteliomului s-au dovedit in vitro că sunt distruse de celulele limfocitelor după activarea interleukinei -2 (IL-2), dar pacienții supuși acestei terapii au prezentat efecte secundare majore. Într-adevăr, acest studiu terapeutic a fost întrerupt din cauza nivelurilor intolerabil ridicate de toxicitate IL-2 și a severității efectelor secundare precum febra și cașexia . Cu toate acestea, alte studii care utilizează interferon alfa au fost încurajatoare, 20% dintre pacienți prezentând o reducere mai mare de 50% a masei tumorale asociate cu efecte secundare minime.
Cercetare
Istoric
Un articol publicat de Wagner și colab. în 1960 a stabilit pentru prima dată că mezoteliomul era o boală rezultată din expunerea la azbest sub formă de crocidolit. Articolul a enumerat mai mult de 30 de cazuri de pacienți care au prezentat mezoteliom în Africa de Sud, inclusiv expuneri temporare și cazuri care implică minori.
În 1962, Dr. McNulty a raportat primul caz de mezoteliom malign diagnosticat în Australia la un lucrător expus azbestului. Muncitorul a lucrat în moara de la mina de azbest Wittenoom din 1948 până în 1950.
În orașul Wittenoom, deșeurile de ambalaje din azbest din mină au fost reciclate pentru acoperirea locurilor de joacă și a zonelor de joacă.
În 1965, a fost scris într-un articol din revista britanică de medicină a muncii că persoanele care locuiseră în vecinătatea fabricilor și a minelor de azbest fără să lucreze acolo avuseseră contractat mezoteliom.
În ciuda dovezilor că praful asociat cu extracția azbestului și măcinarea fibrelor a fost cauza bolilor legate de azbest, extracția a început la Wittenoom în 1943 și a continuat până în 1966.
Este dificil de înțeles de ce mină și moară au fost lăsate mai întâi să se deschidă și apoi să continue să funcționeze fără măsuri adecvate de control al riscului; și de ce nu s-a făcut nimic pentru a forța proprietarul (CSR) să respecte standardele, să adopte metode de lucru mai sigure sau să înceteze operațiunile.
În 1974, primele avertismente publice despre pericolele azbestului albastru au fost publicate într-o revistă a revistei australiene sub forma unei cărți pe copertă tare, cu coperta intitulată „Is That Killer In Your House?” "
În 1978, guvernul Australiei de Vest a decis să distrugă orașul Wittenoom, după publicarea unei broșuri de servicii de sănătate, „The Health Risk in Wittenoom”, care conține rezultatele probelor atmosferice și o evaluare a datelor medicale disponibile la nivel mondial.
În 1979, primele cereri de neglijență din Wittenoom au fost lansate împotriva CSR și filialei sale ABA, iar Asbestos Diseases Society a fost încorporată pentru a reprezenta victimele Wittenoom.
Mezoteliom peritoneal
Definiție
Mezoteliomul peritoneal este o tumoare malignă primară caracterizată prin invazia difuză a suprafețelor peritoneale ( peritoneul are două straturi, unul visceral căptușind exteriorul organelor, celălalt parietal căptușind suprafața interioară a pereților corpului. abdomen).
Epidemiologie
Incidența mezoteliomului peritoneal a crescut universal din 1970. În țările industrializate, incidența sa este estimată astăzi De la 0,5 la 3 cazuri la un milion de locuitori la om și de la 0,2 la 2 cazuri la un milion la femei. Mezoteliomul peritoneal reprezintă 1/5 până la 1/4 din toate formele clinice ale mezoteliomului.
Etiologie
Studii recente par să stabilească legătura la om cu relația dintre expunerea la azbestoză și dezvoltarea mezoteliomului peritoneal. De la primul caz de mezoteliom pleural legat de azbestoză , au fost identificați mai mulți alți agenți cancerigeni. Au fost menționate următoarele: virus-40, radioterapie abdominală, peritonită cronică, expunere la mică și administrare de dioxid de toriu. O posibilă susceptibilitate genetică, cu transmisie autosomală dominantă, după expunerea la erionită, un alt cancerigen incriminat a fost, de asemenea, raportat de Roushdy-Hammady și colab. în Cappadociene, o regiune din Turcia.
Diagnostic și clinică
Descoperirea este adesea legată de o creștere a volumului abdomenului secundar producției de ascită sau formarea tumorii, precum și de durerea abdominală nespecifică. În 10% din cazuri este raportată formarea unei hernii simptomatice. Acesta este cel mai comun mod de descoperire la oameni. La femei, descoperirea incidentală în timpul unei laparoscopii este cea mai frecventă.
Scannerul toraco-abdomino-pelvian este astăzi Examenul morfologic de referință pentru diagnostic, evaluarea extensiei și monitorizarea mezoteliomului peritoneal. Cu toate acestea, permite doar detectarea leziunilor mai mari de 5 mm și subestimează în mare măsură extensia intraperitoneală a bolii.
Tratament
De foarte mult timp, tratamentul mezoteliomului peritoneal a fost paliativ. A combinat chirurgia paliativă simptomatică și chimioterapia sistemică. Astăzi , Un tratament mai agresiv implementat în ultimii douăzeci de ani A modificat considerabil prognosticul patologiei. Această tehnică implică combinarea chirurgiei citoreductive pentru tratamentul bolii macroscopice cu chimioterapia intraperitoneală perioperatorie: chimioterapie imediată postoperatorie și / sau chimioterapie intraperitoneală (IPHP) pentru tratamentul bolii microscopice.
Note și referințe
- (în) [ Nature Reviews Cancer , voi. 7, 2, p. 147-154 (2007)].
- (în) Mezoteliom de azbest și peritoneal În rândul bărbaților cu studii superioare . Welch LS1, Acherman YI, Haile E, Sokas RK, Sugarbaker PH. Int J Occup Environ Health (ro) . 2005 iul-sept; 11 (3): 254-8. https://www.ncbi.nlm.nih.gov/pubmed/16130966
- (în) Nature Reviews Cancer , vol. 7, 2, p. 147-154 (2007), Welch LS, Acherman YI, Haile E, Sokas RK, Sugarbaker PH. Azbest și mezoteliom peritoneal la bărbații cu studii superioare . Int J Occup Environ Health (în) 2005; 11: 254-8.
- (în) Expunerea internă la azbest: o analiză a datelor epidemiologice și a expunerii Goswami E1, V Craven, Dahlstrom DL, Alexander D Mowat F. Int J Aproximativ Res Health Public . 2013 31 octombrie; 10 (11): 5629-70. DOI : 10.3390 / ijerph10115629 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3863863/
- Mezoteliomul devine a 31- a boală cu notificări (MDO) din Franța , comunicat de presă18 ianuarie 2012al Institutului francez de supraveghere a sănătății publice .
- Camille Larue și Marie Carrière, Nanoparticule în ecosistemul solului [PDF] ,februarie 2010 la august 2010, CEA / ADEME, IRAMIS / SIS2M / LSDRM, Gif-sur-Yvette (a se vedea capitolul intitulat Fenomene timpurii în carcinogeneza mezoteliomului ).
- (en) Pass HI, Lott D, Lonardo F și colab. Expunerea la azbest, mezoteliomul pleural și nivelurile serice de osteopontină , N Engl J Med, 2005; 353: 1564-1573.
- (ro) Hollevoet K, Reitsma JB, Creaney J și colab. Mesotelină serică pentru diagnosticarea mezoteliomului pleural malign: o meta-analiză individuală a datelor pacientului , J Clin Oncol , 2012; 30: 1541-1549.
- (en) Pass HI, Levin SM, Harbut MR și colab. Fibulin-3 ca biomarker de sânge și efuziune pentru mezoteliom pleural , N Engl J Med, 2012; 367: 1417-1427.
- Cancer necunoscut publicului larg: mezoteliom (mezoteliom) .
- (ro) Articolul general de revizuire . „ Progresele în mezoteliomul malign ”, Bruce WS Robinson și Richard A. Lake în The New England Journal of Medicine (2005) volum 353 pagini 1591-1603 .
- Buletine electronice: Știință-societate: progrese științifice și evoluții sociale și de sănătate în urma descoperirii unei epidemii de mezoteliom în Capadocia .
- BatiActu și AFP (2014), intitulat pe scurt Azbest, un flagel care ar putea provoca 100.000 de decese până în 2050 , cu AFP (22 august 2014, (consultat la25 august 2014) .
- (în) „ SV40 în tumorile umane: noi lucrări fac lumină asupra aparentei controverse ”, DS MacLachlan în Anticancer Res (2002) Volumul 22 , 3495-3499 pagini .
- [1] .
- Comunicat de InVS , Notificare obligatorie a mezoteliomului: începeți1 st luna ianuarie 2011 de faza pilot în șase regiuni; ianuarie 2011.
- Sabine Casalonga Mezoteliom: a început raportarea obligatorie , Journal de l'Environnement,25 ianuarie 2011.
- (ro) Flores RM, Zakowski M, E Venkatraman și colab. Factori prognostici în tratamentul mezoteliomului pleural malign la un centru terțiar de referință mare , J Thorac Oncol (en) , 2007; 2: 957-965.
- (ro) Vogelzang NJ, Rusthoven JJ, Symanowski J și colab. Studiu de fază III a pemetrexedului în asociere cu cisplatină versus cisplatină în monoterapie la pacienții cu mezoteliom pleural malign , J Clin Oncol , 2003; 21: 2636-2644.
- (en) van Meerbeeck JP, Gaafar R, Manegold C și colab. Studiu randomizat de fază III al cisplatinei cu sau fără raltitrexed la pacienții cu mezoteliom pleural malign: un studiu intergrup al Organizației Europene pentru Cercetarea și Tratamentul Cancerului Pulmonar Cancer Group și Institutul Național al Cancerului din Canada , J Clin Oncol, 2005; 23: 6881 -6889.
- (ro) Santoro A, O'Brien ME, Stahel RA și colab. Pemetrexed plus cisplatin sau pemetrexed plus carboplatin pentru pacienții chemonaivi cu mezoteliom pleural malign: rezultatele Programului internațional de acces extins , J Thorac Oncol (en) , 2008; 3: 756-763.
- (ro) Karrison T, Kindler HL, Gandara DR și colab. Analiza finală a unui multicentric, dublu-orb, randomizat , controlat cu placebo de faza II de gemcitabina / cisplatină (GC) plus bevacizumab (B) sau placebo (P) la pacienții (pts) cu mezoteliom malign (MM) , J Clin Oncol, 2007; 25 (18S): 7526 (abstr).
- (în) Zalcman, " bevacizumab pentru mezoteliom pleural nou diagnosticate în mezoteliom Cisplatina Studiul Avastin pemetrexed (MAPS): un studiu randomizat, controlat, deschis, de faza 3 studiu " , The Lancet ,21 decembrie 2015( citește online ).
- (în) „ Mezoteliom pleural difuz și expunere la azbest în provincia North Western Cape ”, JC Wagner, CA Sleggs și P. Marchand în Br J Ind Med. (1960) volumul 17 , paginile 260-271 Introduceți PubMed 13782506 .
- (în) " Mezoteliom pleural malign în anul lucrătorului cu azbest " , JC McNulty în Med J Aust (1962) Volumul 49 , 953-954 pagini .
- Profesorul Olivier Glehen, medicul Eddy Cotte, asociația AMARAPE.
- (en) Boffetta P. Epidemiologia mezoteliomului peritoneal: o revizuire . Ann Oncol (în) 2006.
- (în) Sugarbaker PH, Yan TD Stuart OA Yoo D. Management cuprinzător al mezoteliomului peritoneal malign difuz . Eur J Surg Oncol (de) 2006; 32: 686-91.
- (ro) Welch LS, Acherman YI Haile E, Sokas RK, Sugarbaker PH. Azbest și mezoteliom peritoneal la bărbații cu studii superioare . Int J Occup Environ Health (în) 2005; 11: 254-8.
- (ro) Bochetta M, Di Resta I, Powers A, Fresco R Tosolini A, Testa JR și colab. Celulele mezoteliale umane sunt neobișnuit de sensibile la transformarea mediată de virusul simian 40 și la cocarcinogenitatea azbestului . Proc Natl Acad Sci SUA 2000; 97: 10214-9.
- (ro) Gilks B, C Hegedus, Freeman H, Fratkin L, Churg A. Mezoteliom peritoneal malign După radiații abdominale la distanță . Rac 1988; 61: 2019-21.
- (în) Peterson JT, Jr., Greenberg SD, Buffler PA. Mezoteliom malign care nu este legat de azbest. O recenzie . Rac 1984; 54: 951-60.
- (în) Chahinian AP, Pajak TF, Holland JF, Norton L, Ambinder RM, EM Mandel. Mezoteliom malign difuz. Evaluarea prospectivă a 69 de pacienți . Ann Intern Med 1982; 96: 746-55.
- (ro) Maurer R, Egloff B. Mezoteliom peritoneal malign După colangiografie cu torotrast . Rac 1975; 36: 1381-5.
- (în) Roushdy-Hammady I. Etiologie contestată: Risc de cancer În rândul a două populații anatoliene din Turcia și Europa . Cult Med Psychiatry (în) 2004; 28: 315-39.
- (ro) Glehen O MF, Gilly FN. Carcinomatoza peritoneală din cancerul tractului digestiv: nou tratament prin chirurgie citoreductivă și chimioterapie intraperitoneală . Lancet Oncol . 2004; 5: 219-28.
Vezi și tu
Articole similare
- Henri Pézerat
- Les Sentinelles , un documentar produs de fiul lui Henri Pérezat: Pierre Pézerat, retrage munca și lupta cercetătorului cu mărturiile lui Annie Thébaud-Mony și ale numeroaselor victime ale bolilor profesionale.
linkuri externe
- (ro) Incidența mezoteliomului [PDF]
- (ro) Tip mezoteliom: Întrebări și răspunsuri .
- (ro) Societatea Americană a Cancerului
- (fr) Intergrup de oncologie toracică francofonă (IFCT): studii clinice
- (ro) Asocierea împotriva bolilor rare ale peritoneului
- Rețeaua națională pentru gestionarea tumorilor rare ale peritoneului (RENAPE)