Fenol (compus)
| Fenol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Structura fenolului | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificare | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Numele IUPAC | fenol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sinonime |
Fenolic |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o ECHA | 100.003.303 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o EC | 203-632-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DrugBank | DB03255 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 996 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| FEMA | 3223 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ZÂMBETE |
c1 (ccccc1) O , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
InChI: InChI = 1 / C6H6O / c7-6-4-2-1-3-5-6 / h1-5.7H |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspect | cristale incolore până la galbene sau roz deschis, cu miros caracteristic | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietăți chimice | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Formula brută |
C 6 H 6 O [izomeri] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masă molară | 94,1112 ± 0,0055 g / mol C 76,57%, H 6,43%, O 17%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| pKa | pKa (PhOH 2 + / PhOH) = -6,4 pKa (PhOH / PhO - ) = 9,95 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Momentul dipolar | 1,224 ± 0,008 D | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diametrul molecular | 0,555 nm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietăți fizice | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fuziune | 43 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fierbere | 182 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solubilitate | 76,04 g · l -1 apă | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Parametrul de solubilitate δ |
25,1 J 1/2 · cm -3/2 ( 40 ° C ); 11,4 cal 1/2 · cm -3/2 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa volumică |
1,073 g · cm -3
ecuaţie:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Temperatura de autoaprindere | 715 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punct de aprindere | 79 ° C (cupă închisă) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Limite explozive în aer | 1,36 - 10 % vol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presiunea saturată a vaporilor | la 20 ° C : 47 Pa
ecuaţie:

|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punct critic | 61,3 bari , 694,2 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termochimie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
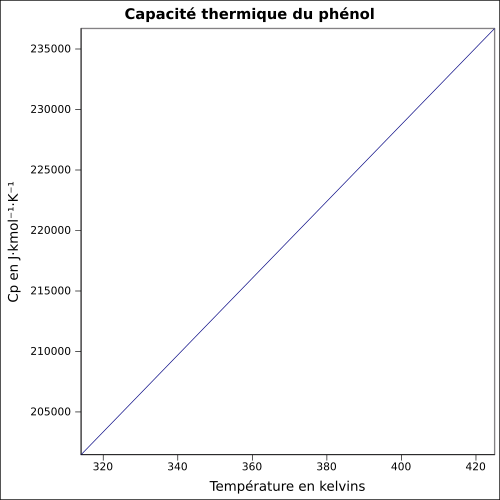
| C p |
ecuaţie:
ecuaţie:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| BUC | 3 053,5 kJ · mol -1 ( 25 ° C , solid) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cristalografie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Clasa de cristal sau grup spațial | P 112 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Parametrii mesh |
a = 6,050 Å b = 8.925 Å |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volum | 788.01 Å 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietati optice | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Indicele de refracție | 1,5427 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Precauții | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   Pericol H301, H311, H314, H331, H341, H373, H301 : Toxic în caz de înghițire H311 : Toxic în contact cu pielea H314 : Provoacă arsuri grave ale pielii și leziuni oculare H331 : Toxic dacă este inhalat H341 : Suspect că provoacă defecte genetice (indicați calea de expunere dacă este cazul) este dovedit în mod concludent că nu există altă cale de expunerea duce la același pericol) H373 : Riscul presupus de deteriorare gravă a organelor (indicați toate organele afectate, dacă sunt cunoscute) după expunere repetată sau expunere prelungită (indicați calea de expunere dacă se dovedește în mod concludent că nici o altă cale de expunere nu duce la același pericol) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  D1A, E, D1A : Material foarte toxic cu efecte imediate grave Transportul mărfurilor periculoase: clasa 6.1 grupa II E : Necroza materialului coroziv al pielii la animale Divulgarea la 1,0 % conform listei de divulgare a ingredientelor |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 4 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transport | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
60 : material toxic sau care prezintă un grad minor de toxicitate Număr ONU : 1671 : PHENOL SOLID Clasa: 6.1 Etichetă: 6.1 : Substanțe toxice Ambalare: Grupa de ambalare II : substanțe moderat periculoase; 
60 : material toxic sau care prezintă un grad minor de toxicitate Număr ONU : 2312 : FENOL MOLTEN Clasa: 6.1 Etichetă: 6.1 : Substanțe toxice Ambalare: Grupa de ambalare II : substanțe moderat periculoase; 
60 : material toxic sau care prezintă un grad minor de toxicitate Număr ONU : 2821 : SOLUȚIE DE FENOL Clasă: 6.1 Etichetă: 6.1 : Substanțe toxice Ambalare: Grupa de ambalare II / III : substanțe moderat / ușor periculoase.  |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Clasificarea IARC | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupa 3: Inclasificabil în ceea ce privește carcinogenitatea sa la om | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ecotoxicologie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LogP | 1,46 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pragul mirosului | minim: 0,0045 ppm înalt: 1 ppm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unități de SI și STP, cu excepția cazului în care se prevede altfel. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Fenol , de asemenea , cunoscut sub numele de hidroxibenzen , carbolic acidă sau acidul carbolic , este compus dintr - un miez fenil și o funcție hidroxil . Este cea mai simplă moleculă din familia fenolilor .
Reprezentări
-
Model compact
-
Model de bile și bastoane
Istorie
Acesta este descoperit într - o stare impură de Johann Rudolf Glauber în 1650 , de la distilarea de gudron de cărbune . Glauber îl descrie ca „ un ulei de sânge roșu aprins care se usucă și vindecă toate ulcerele umede ”.
În 1834 , Friedrich Ferdinand Runge a reușit să îl izoleze și l-a numit acid carbolic .
În 1836, Auguste Laurent a inventat termenul „fen” pentru benzen; aceasta este rădăcina termenilor „fenol” și „fenil”.
În 1841, chimistul francez Auguste Laurent l-a obținut într-o formă pură.
Din 1865 până în anii 1880, fenolul a fost folosit ca antiseptic sub conducerea lui Joseph Lister , reducând rata mortalității în timpul intervenției chirurgicale de la 65% la 20%.
Fenolul a fost sintetizat și fabricat în 1889 de către compania BASF .
Enol
Fenolul este, de asemenea, un enol (derivat alcoolic cu funcție de alchenă). Este forma tautomerică a ciclohexa-2,4-dienonei. Dar, spre deosebire de majoritatea enolilor, este cea mai stabilă formă în comparație cu cetona sa tautomerică, stabilitate datorată în principal prezenței unui inel aromatic care nu este prezent în cetona corespunzătoare.

Proprietăți fizice
Fenolul are o constantă moloscală crioscopică de 6,84 ° C ∙ kg / mol și o constantă molală ebullioscopică de 3,54 ° C ∙ kg / mol.
De culoare alb pur, tinde să se oxideze ușor la contactul cu aerul pentru a da urme de chinone care îl colorează roz, apoi roșu.
Producție
În 2005, la nivel mondial au fost produse 8,8 milioane de tone de fenol, dintre care aproximativ 26% în Statele Unite și 2% în Franța. Principalul producător este Ineos Phenol (Regatul Unit) cu o capacitate de producție de 1,6 milioane de tone.
Peste 85% din fenol este produs astăzi prin procesul cumenic . Acest proces, dezvoltat în 1944 de Hock și Lang, a fost utilizat încă din anii 1950. Avantajul său constă în simplitatea implementării sale, randamentul său bun (90%) și faptul de a obține fenol și acetonă din cumen, disponibile în cantități mari. de către produse petrochimice . Acesta constă dintr-o oxidare a cumenului prin aer, furnizând hidroperoxid de cumen ca intermediar care, într- un mediu apos acid , dă fenol și acetonă.
utilizare
- Două treimi din producția de fenol este utilizată pentru a produce materiale plastice ( policarbonate , rășini epoxidice ).
- Intermediar important pentru multe sinteze de produse farmaceutice. Vezi Fenol (grup) .
- În parfumerie : timol , estragol , eugenol , vanilină etc.
- În medicină , este utilizat în principal ca antiseptic puternic. De asemenea, este utilizat în dermatologie în tratamentul unghiilor încarnate (fenolizare).
- În biologia moleculară , fenolul este utilizat pentru a elimina proteinele din protocoalele de extracție a acidului nucleic .
- Prepararea fenolftaleinei , un indicator metric al pH-ului, bine cunoscut chimistilor.
- Prin acțiunea clorului gazos asupra fenolului, se obțin clorofenoli , cum ar fi 2,4,6-triclorofenol .
- Folosit în entomologie pentru conservarea paturilor de insecte împotriva mucegaiurilor.
- În alimente , pentru conservarea cărnii .
- Fenolul este utilizat pentru producerea hârtiei.
- În combinație cu acid sulfuric concentrat, este utilizat ca metodă de colorare a carbohidraților pentru determinarea lor prin spectrofotometrie .
Securitate
Fenolul este foarte coroziv pentru organismele vii. O soluție apoasă de 1% este suficientă pentru a provoca iritații severe.
Arsurile cu fenol sunt foarte dureroase și durează mult timp pentru a se vindeca. În plus, pot fi urmate de complicații grave care pot duce la moarte datorită toxicității acestui compus și capacității acestuia de a pătrunde în organism prin piele.
Aceste proprietăți fac din fenol un agent al mutilării genitale feminine . Într-adevăr, D r Kellogg a susținut arderea fenolului clitoris ca „remediu” împotriva masturbării.
În timpul celui de-al doilea război mondial , prizonierii din Auschwitz și alte tabere au fost executați printr-o puncție de fenol în inimă. Maximilien Kolbe a fost ucis de o injecție de fenol în braț, după paisprezece zile de detenție fără alimente. Doctorul SS Karl Babor care oficiază în lagărul Gross-Rosen era specialist în asasinarea seringii cu fenol.
Articole similare
- Cresol , fenol substituit cu o grupare metil
-
Benzenediol , fenol substituit cu o a doua grupare hidroxil
- Pirocatechol (catecol), izomer orto
- Resorcinol (resorcinol), metaizomer
- Hidrochinona , para izomer
- Benzenetriol
- Benzenetetrol
- Benzenepentol
- Benzenhexol
Note și referințe
- PHENOL , fișă (e) de siguranță a Programului internațional privind siguranța substanțelor chimice , consultat la 9 mai 2009
- (în) David R. Lide, Manual de chimie și fizică , Boca Raton, CRC,16 iunie 2008, 89 th ed. , 2736 p. ( ISBN 978-1-4200-6679-1 și 1-4200-6679-X ) , p. 9-50
- (en) Yitzhak Marcus, The Properties of Solvents , vol. 4, Regatul Unit, John Wiley & Sons Ltd,1999, 239 p. ( ISBN 0-471-98369-1 )
- calculate în masă moleculară de „ masele atomice ale elementelor 2007 “ pe www.chem.qmul.ac.uk .
- (ro) Șerban Moldoveanu, Pregătirea probelor în cromatografie , Elsevier ,2002, 930 p. ( ISBN 0-444-50394-3 ) , p. 258
- (în) JG Speight, Norbert Adolph Lange, Lange's Handbook of Chemistry , McGraw-Hill,2005, Ediția a 16- a . , 1623 p. ( ISBN 0-07-143220-5 ) , p. 2.289
- (ro) Robert H. Perry și Donald W. Green , Perry's Chemical Engineers 'Handbook , SUA, McGraw-Hill,1997, A 7- a ed. , 2400 p. ( ISBN 0-07-049841-5 ) , p. 2-50
- „ Proprietățile diferitelor gaze ” , la flexwareinc.com (accesat la 12 aprilie 2010 )
- (în) Carl L. Yaws, Manual de diagrame termodinamice: compuși organici de la C8 la C28 , vol. 2, Huston, Texas, Gulf Pub. Co,1996, 396 p. ( ISBN 0-88415-858-6 )
- (în) David R. Lide , Manualul de chimie și fizică al CRC , Boca Raton, CRC Press,18 iunie 2002, 83 th ed. , 2664 p. ( ISBN 0849304830 , prezentare online ) , p. 5-89
- (en) „ Fenol ” , la www.reciprocalnet.org (accesat la 12 decembrie 2009 )
- Grupul de lucru IARC privind evaluarea riscurilor cancerigene pentru oameni, „ Evaluări globale ale carcinogenității pentru oameni, grupul 3: neclasificabil în ceea ce privește carcinogenitatea lor pentru oameni ” , pe http://monographs.iarc.fr , IARC,16 ianuarie 2009(accesat la 22 august 2009 )
- Număr index (en) în tabelul 3.1 din anexa VI la regulamentul CE nr . 1272/2008 (16 decembrie 2008)
- „ Fenol ” în baza de date a substanțelor chimice Reptox a CSST (organizația din Quebec responsabilă de securitatea și sănătatea în muncă), accesată la 25 aprilie 2009
- Introducere „Fenol” în baza de date chimice GESTIS a IFA (organism german responsabil cu securitatea și sănătatea în muncă) ( germană , engleză ), accesat la 25 august 2009 (este necesar JavaScript)
- (în) „ Fenol ” pe hazmap.nlm.nih.gov (accesat la 14 noiembrie 2009 )
- Auguste Laurent, Despre clorofeniză și acizi clorofenizici și clorofenezici ,1836, Dau numele de fene radicalului fundamental al acizilor precedenți ( φαινω , iluminez), deoarece benzina se găsește în gazul iluminării.
- Annales de chimie et de physique , V. Masson (Paris), 1816-1913 ( citește online )
- (în) Site web corporativ
- Datele privind producția industrială de fenol , Chemical Society din Franța , 8 th ed. , 2009
- Heinrich Hock (1887-1971) este un chimist german, format la Universitatea Tehnică din München de Karl Andreas Hofmann . A predat din 1927 până în 1958 la Institut des Charbonnages din Mülheim, apoi chimia explozivilor la École des Mines din Clausthal .
- Shon Lang a fost colegul lui Heinrich Hock la Clausthal.
- „ Tratamentul unghiilor încorporate pentru unghiile incarnate ale fenolului cu e-sante.fr ” pe e-sante.fr (accesat la 6 mai 2016 ) .
- (în) Michel. DuBois , KA Gilles , JK Hamilton și PA Rebers , „ Metoda colorimetrică pentru determinarea zaharurilor și a substanțelor conexe ” , Chimie analitică , vol. 28, n o 3,Martie 1956, p. 350–356 ( ISSN 0003-2700 și 1520-6882 , DOI 10.1021 / ac60111a017 , citit online , accesat la 10 noiembrie 2019 )
- S. Suzanne Nielsen , „Metoda acidului fenol-sulfuric pentru carbohidrații totali” , în Manualul de analiză a alimentelor , Springer SUA,2010( ISBN 9781441914620 , DOI 10.1007 / 978-1-4419-1463-7_6 , citit online ) , p. 47-53
- (în) John Harvey Kellogg, Plain Facts for Old and Young ,1888, 644 p. ( ISBN 978-0-405-05808-0 )