Proteină fluorescentă verde
Proteină fluorescentă verde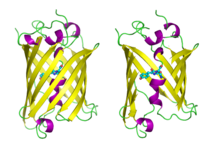 Proteină fluorescentă verde prezentată întreagă în stânga și deschisă în dreapta pentru a arăta cromoforul ( PDB 1GFL )
Proteină fluorescentă verde prezentată întreagă în stânga și deschisă în dreapta pentru a arăta cromoforul ( PDB 1GFL )
| Pfam | PF01353 |
|---|---|
| Clanul Pfam | CL0069 |
| InterPro | IPR011584 |
| SCOP | Primul |
| SUPERFAMILIE | Primul |
Proteina verde fluorescentă (adesea abreviat GFP , The limba engleză " Green Fluorescent Protein ") este o proteină care are proprietatea de a emite fluorescență de culoare verde . Derivată de la o meduză ( Aequorea victoria ), această proteină este intrinsec fluorescentă sub acțiunea unei enzime, aequoreina, o luciferază care acționează în prezența calciului. Gena sa poate fi fuzionată in vitro cu gena unei proteine pe care se dorește să o studieze. Gena recombinantă este apoi reintrodusă în celule sau un embrion , care va sintetiza apoi proteina de fuziune , care este apoi fluorescent. Apoi poate fi observat folosind un microscop cu fluorescență , de exemplu. Această metodă face posibilă studierea proteinelor din mediul lor natural: celula vie. Descoperirea și aplicații ale MFP au fost încununate de cu Premiul Nobel pentru chimie acordat Osamu Shimomura , Martin Chalfie și Roger Tsien8 octombrie 2008.
Structura
GFP a fost descris pentru prima dată în 1962 . Este alcătuit din 238 de aminoacizi pentru o masă moleculară de aproximativ 27 kDa. Cromofor (centrul activ responsabil pentru fluorescență) este formată din catenele laterale ale unei glicină , o tirozina și o serină .
GFP nemodificat, numit tip sălbatic ( tip sălbatic GFP , wGFP) are două excitații maxime. Primul se găsește cu o lungime de undă de 395 nm (lumină UV), al doilea la 475 nm (lumină albastră). Lungimea de undă maximă a emisiilor este de 504 nm . Este, de asemenea, foto-excitabil, ceea ce înseamnă că intensitatea fluorescenței emise este intensificată prin expunerea la fotoni ultraviolete, caracteristică pierdută în majoritatea variantelor produse ulterior.
Acum există diferite variante de GFP care au fost obținute prin modificarea acestuia prin inginerie genetică. Există, de asemenea, alte proteine fluorescente din alte organisme decât A. Victoria :
- EGFP: fluorescență verde ( GFP îmbunătățit );
- CFP : fluorescență cian (albastru-verde), și varianta sa ceruleană;
- E YFP : fluorescență galbenă (Y pentru galben ), și variantele sale Venus și Citrin;
- E BFP : fluorescență albastră și varianta sa Azurite:
- PA-GFP: GFP foto-activabil la 405 nm :
- PHluorină: GFP sensibil la pH, se stinge la pH acid.
S-a demonstrat că GFP fuzionat cu o proteină poate ajuta la plierea acesteia din urmă în timpul exprimării genei sale .
Alte proteine fluorescente
- DsRed : fluorescență roșie, dintr-un coral , din genul Discosoma. Este la originea unei a doua familii de variante din gama roșu-portocaliu.
- Keima : fluorescență roșie cu excitație în albastru ( schimbare Stokes mare)
Utilizare în cercetarea biologică
Principiu
Proteina fluorescentă verde poate fi utilizată ca genă reporter . Asociat cu o genă de interes, permite observarea directă a expresiei acestei gene în celulă în microscopie cu fluorescență . Gena care codifică proteina GFP este încorporată în genomul organismului, în regiunea genei care codifică proteina de interes și care va fi astfel controlată de aceeași secvență reglatoare. În celulele în care gena va fi exprimată și proteina de interes produsă, GFP va fi sintetizat în același timp. Astfel, aceste celule vor deveni fluorescente în timp ce cele care nu exprimă gena de interes vor rămâne inerte sub lumina microscopiei fluorescente .
Beneficii
Observarea GFP este neinvazivă: poate fi observată direct prin iluminarea probei cu lumină de o anumită lungime de undă. În plus, GFP este o moleculă relativ mică și inertă, care nu pare să interacționeze cu niciun proces biologic de interes. Deoarece GFP este un monomer , se poate difuza rapid prin celule. Genele reporter utilizate înainte de GFP, cum ar fi beta-galactozidaza, implicau „fixarea” (uciderea) organismului sau celulelor astfel încât acestea să poată fi observate, în timp ce GFP se acumulează în celulele vii în timp real, ceea ce permite observarea schimbărilor de expresie în timpul experiment. În plus, face posibilă măsurarea variației dintre indivizi (celule) dintr-un eșantion. În cele din urmă, PFM este ereditar.
Microscopie fluorescentă
Descoperirea GFP și a proteinelor sale derivate a schimbat profund microscopia cu fluorescență și utilizarea sa în biologia celulară. În timp ce majoritatea moleculelor fluorescente mici, cum ar fi Fluoresceina, sunt foarte toxice atunci când sunt utilizate în celulele vii, proteinele fluorescente precum GFP sunt mult mai puțin periculoase atunci când sunt iluminate în probă. Acest lucru a declanșat dezvoltarea de sisteme automate de monitorizare a expresiei altor proteine ale căror gene au fost corelate cu cea a GFP sau a altor proteine similare. Această tehnică poate fi utilizată in vitro sau in vivo .
Aplicații
Noile linii de șobolani transgenici GFP sunt folosite pentru cercetări în terapia genică , precum și în medicina regenerativă. Acest lucru se datorează faptului că majoritatea celulelor marcate cu o genă reporter generează un răspuns imun atunci când sunt introduse într-o gazdă. Liniile de șobolan care exprimă GFP la un nivel ridicat în toate celulele lor ar putea servi drept sursă de celule care trebuie introduse într-o altă gazdă, care este mai puțin probabil să provoace respingere. GFP este, de asemenea, utilizat pe scară largă în cercetarea cancerului, pentru a marca și urmări celulele canceroase. Aceste celule au fost utilizate pentru modelarea metastazelor, procesul prin care celulele canceroase se răspândesc în alte organe.
PFM în Arte Plastice
Julian Voss-Andreae , un Germano - născut artist specializat în „sculpturi de proteine“, sculpturi realizate pe baza structurii GFP, inclusiv 1.70m înalt sculptura cu denumirea proteina cu fluorescență verde (2004) și oțel Meduze sculptura (2006), 1,40 m de mare . Acesta din urmă este instalat în laboratoarele Friday Harbor ale Universității din Washington, unde GFP a fost descoperit de Shimomura în 1962.
Eduardo Kac , un artist care folosește PFM pentru lucrările sale BioArt.
Vezi și tu
Articole similare
- GloFish , o marcă înregistrată a peștilor zebră modificată genetic prin introducerea în genomul său a unei gene pentru o proteină fluorescentă care conferă culori roșii, verzi și portocalii deschise.
- Biologul american Tulle Hazelrigg a fost primul care a atașat proteina fluorescentă verde la alte proteine.
linkuri externe
Note și referințe
- Chimie: Nobel pentru meduzele fluorescente în Eliberare din 8 octombrie 2008.
- Premiul Nobel pentru chimie 2008: o meduză fluorescentă recompensată Un articol École normale supérieure - DGESCO.
- Chalfie M, " GFP: Lighting up life ", Proceedings of the National Academy of Sciences din Statele Unite ale Americii , vol. 106, nr . 25,Iunie 2009, p. 10073-10080 ( PMID 19553219 , DOI 10.1073 / pnas.0904061106 ).
- Mark R. Soboleski, Jason Oaks și William P. Halford, „ Proteina fluorescentă verde este un reporter cantitativ al expresiei genelor în celulele eucariote individuale ”, The FASEB Journal , vol. 19,ianuarie 2005( PMID 15640280 , DOI 10.1096 / fj.04-3180fje ).
- Yuste R, „ Microscopia fluorescenței astăzi ”, Nature Methods , vol. 2, n o 12,decembrie 2005, p. 902–4 ( PMID 16299474 , DOI 10.1038 / nmeth1205-902 ).
- Chudakov DM, Lukyanov S, Lukyanov KA, „ Proteinele fluorescente ca set de instrumente pentru imagistica in vivo ”, Trends in Biotechnology , vol. 23, n o 12,decembrie 2005, p. 605-13 ( PMID 16269193 , DOI 10.1016 / j.tibtech.2005.10.005 ).
- .
- Kouros-Mehr H, Bechis SK, Slorach EM, Littlepage LE, Egeblad M, Ewald AJ, Pai SY, Ho IC, Werb Z, „ GATA-3 leagă diferențierea și diseminarea tumorii într-un model de cancer de sân luminal ”, Cancer Cell , zbor. 13, n o 2Februarie 2008, p. 141–52 ( PMID 18242514 , PMCID 2262951 , DOI 10.1016 / j.ccr.2008.01.011 ).
- (în) J Voss-Andreae , „ Protein Sculptures: Life's Building Blocks Inspire Art ' , Leonardo , vol. 38,2005, p. 41–45 ( DOI 10.1162 / leon.2005.38.1.41 ).
- (în) Alexander Pawlak , " Inspirierende Protein " , Physik Journal , vol. 4,2005, p. 12.
- (în) „ Julian Voss-Andreae Sculpture ” (accesat la 14 iunie 2007 ) .
- Nature Biotechnology - 24, 1569 - 1571 (2006)
- Nature Biotechnology 24, 577-581 (2006)
- Nature Biotechnology 22, 1524 - 1525 (2004)