Ion hidroniu
| Ion hidroniu | |
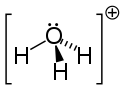   Structura ionului hidroniu. |
|
| Identificare | |
|---|---|
| Numele IUPAC | oxoniu |
| N o CAS | |
| PubChem | 123332 |
| ChEBI | 29412 |
| ZÂMBETE |
[OH3 +] , |
| InChI |
InChI: InChI = 1S / H2O / h1H2 / p + 1 InChIKey: XLYOFNOQVPJJNP-UHFFFAOYSA-O |
| Proprietăți chimice | |
| Formula brută | H 3 O + (aq) |
| Masă molară | 19,0232 ± 0,0005 g / mol H 15,9%, O 84,1%, |
| pKa | −1,74 la 25 ° C |
| Unități de SI și STP, cu excepția cazului în care se prevede altfel. | |
Ion hidroniu este cel mai simplu dintre ionii de oxoniu ; formula sa chimică este H 3 O +sau H + (aq). În soluție apoasă , este solvatat de un număr de molecule de apă și poate fi scris H 7 O 3 +, H 9 O 4 +etc. Rezultă din protonarea unei molecule de apă fie printr-un acid, fie prin autoprotoliza apei. Există, de asemenea, în stare solidă și în stare de gaz. Este, de asemenea, un ion care se găsește în mediul interstelar , unde rezultă din interacțiunea moleculelor de apă cu radiația cosmică .
Nomenclatură
Nomenclatura IUPAC pentru chimia organică recomandă denumind ion H 3 O +de oxoniu . Termenul de hidroxoniu poate fi folosit și pentru evitarea îndoielilor . Un proiect de recomandare IUPAC ar recomanda, de asemenea, utilizarea termenului oxidaniu în contextul chimiei anorganice în mod specific, dar acest nume este astăzi neobișnuit în practică.
Geometrie
Deoarece ionul O + și atomul de N au același număr de electroni , ionul H 3 O +este izoelectronic cu molecula de amoniac NH 3, de unde și geometria sa piramidală trigonală cu, în partea de sus, atomul de oxigen. Unghiul HOH este de ordinul 113 °.
Rezolvarea
Solvarea de ioni hidroniu în apă nu este încă pe deplin caracterizat. Geometria predominantă dedusă din crioscopia apei ar fi H 3 O + (H 2 O) 6 : fiecare ion este solvatat în medie de șase molecule de apă, care nu mai pot solvata un alt ion.
Alte structuri de solvatare implică mai multe molecule de apă, în special H 3 O + (H 2 O) 20în care ionul hidroniu se află în centrul unui dodecaedru de apă. Simulările efectuate de ab initio metoda de chimie cuantică ar indica , totuși , că protonul hidratat va fi localizat în medie , mai degrabă , la suprafața H 3 O + (H 2 O) agregat 20.
O echipă californiană a propus în 2010 un nou model bazat pe analizele sale de spectroscopie în infraroșu conform cărora protonii sunt solvați sub formă de agregate [H 13 O 6 ] +în care sarcina electrică pozitivă ar fi distribuită fără discriminare între cele șase molecule de apă.
H 3 O + monomerfaza lichidă a fost identificat în 1979 prin rezonanță magnetică nucleară în oxigen 17 într - o soluție de superacid slab neapoase nucleofil HF-SBF 5 SO 2( fluorură de hidrogen , pentafluorură de antimoniu , dioxid de sulf ).
Ionul oxoniu este prezent permanent în apă, datorită reacției de autoprotoliză :
- În primul rând există disocierea unei molecule de apă: H 2 O H + + HO -
- Apoi, o a doua moleculă de apă solvatează protonul eliberat: H 2 O+ H + H 3 O +
- În cele din urmă, protonul solvatat obținut, numit ion oxoniu , este hidratat în soluție și, prin urmare, se notează H 3 O + (aq), prescurtat ca „apos” în legătură cu faptul că este în soluție.
Schema generală de reacție poate fi scrisă:
2 H 2 O H 3 O + (aq) + HO - (aq)HO - (aq)fiind ionul hidroxid , de asemenea solvatat.
pH-ul apei pure la 25 ° C
Constanta de echilibru a autoprotolysis de apă la 25 ° C este:
K eq = [H 3 O +] × [HO - ] / [H 2 O] 2 = 10 -14 .O constantă de echilibru nu se aplică concentrațiilor, ci activităților. Activitatea apei H 2 O solventul este cel al unui lichid practic pur și este egal cu 1 prin convenție.
Constanta de ionizare a apei la 25 ° C este scrisă:
K e = K eq × [H 2 O] 2 = [H 3 O +] × [HO - ] = 10 -14 ,ceea ce înseamnă că :
[H 3 O +] = [HO - ] = 10 -7 ,de aici valoarea pH - ului apei pure la 25 ° C :
pH = - log 10 ([H 3 O +]) = 7.Ioniul oxoniu este responsabil pentru proprietatea acizilor conform definiției lui Joannes Brønsted . Este prezent în orice soluție apoasă în echilibru cu ionul hidroxid HO - . Măsurarea concentrației sale face posibilă determinarea pH - ului soluției.
Referințe
- [1]
- calculate în masă moleculară de „ masele atomice ale elementelor 2007 “ pe www.chem.qmul.ac.uk .
-
(ro) Jian Tang și Takeshi Oka , „ Spectroscopie în infraroșu a H 3 O +
: The ν 1 Fundamental Band ” , Journal of Molecular Spectroscopy , vol. 196, nr . 1,Iulie 1999, p. 120-130 ( citiți online )
DOI : 10.1006 / jmsp.1999.7844 -
DOI : 10.1021 / ja9101826 -
(în) Gheorghe D. Mateescu, George M. Benedikt , „ Apa și sistemele conexe. 1. Ionul hidroniu (H 3 O +
). Prepartare și caracterizare prin rezonanță magnetică nucleară de înaltă rezoluție oxigen-17 ” , Journal of the American Chemical Society , vol. 101, nr . 14,1979, p. 3959-3960 ( citiți online )
DOI : 10.1021 / ja00508a040
