Simetria moleculară
Simetrie moleculară , în chimie , este de a descrie simetriile prezent într - o moleculă (sau un cristal ) și de a clasifica moleculele în funcție de simetria lor.
Simetria moleculară este un concept fundamental în chimie, deoarece ne permite să înțelegem sau să prezicem multe proprietăți chimice . Mobilizează instrumente matematice precum noțiunea de grup , în special grupul de simetrie și grupul de simetrie punctuală .
Chimia moleculară, cea a complexelor de coordonare , studiul orbitalilor moleculari , precum și spectroscopia entităților și complexelor moleculare utilizează notația Schoenflies pentru a descrie la ce punct grupul de simetrie este atașată o moleculă. În cristalografie , simbolurile Hermann-Mauguin sunt folosite în schimb .
Operațiile de simetrie pot fi reprezentate în mai multe moduri . Acest lucru se poate face, de exemplu, folosind matrici ale căror coloane reprezintă, pentru o bază dată, coordonatele noilor vectori obținuți după transformarea vectorilor bazei prin operația de simetrie. Urma acestei matrice se numește caracter al reprezentării.
Reprezentările ireductibile ale grupului sunt adesea folosite deoarece toate celelalte reprezentări ale grupului pot fi descrise ca sume directe de reprezentări ireductibile ( teorema lui Maschke ).
O operație de simetrie este o transformare geometrică care schimbă atomi echivalenți sau lasă atomi invarianți. Pentru fiecare grup de puncte, un tabel de caractere rezumă informațiile despre operațiile de simetrie ale grupului și reprezentările sale ireductibile. Astfel putem stabili o listă de tabele de caractere utile în chimie (en) . În aceste tabele, fiecare rând corespunde unei reprezentări ireductibile (notate printr-o etichetă de simetrie), fiecare coloană unei operații de simetrie (notate prin notația sa Schoenflies), iar ultimele două coloane indică care sunt vectorii obișnuiți, în special orbitalii atomici , care urmăresc transformările indicate de fiecare reprezentare ireductibilă.
Într-adevăr, dacă toate operațiile de simetrie ale grupului de care este atașată molecula îl lasă neschimbat pe acesta din urmă, o operație a grupului nu lasă neapărat fiecare dintre vectorii considerați neschimbați. Vectorii considerați sunt adesea orbitali atomici sau vectori spațiali a căror variație descrie o vibrație moleculară . Acesta este motivul pentru care atașăm fiecăruia dintre acești orbitali sau fiecăruia dintre acești vectori o etichetă de simetrie care corespunde reprezentării "sale" ireductibile în grupul moleculei, adică reprezentării ireductibile a grupului care descrie transformările considerat vector. Astfel, a spune că doi orbitali moleculari sunt „de aceeași simetrie” înseamnă că au aceeași reprezentare ireductibilă. Acest vocabular este utilizat în special în spectroscopie, unde tranzițiile dintre două niveluri de energie vor fi considerate „permise de simetrie” dacă apar între doi orbitali de aceeași simetrie, în sensul indicat aici.
Operații de simetrie și elemente de simetrie
Există cinci familii de operații de simetrie care pot lăsa neschimbată geometria unei molecule: reflexii, inversiuni, rotații, rotații necorespunzătoare și elementul neutru. Fiecare operație de simetrie este asociată cu un element de simetrie, cum ar fi o axă, un plan sau un centru: de exemplu, o rotație se face în jurul unei axe de simetrie, iar o reflecție se face cu privire la un plan de simetrie.
Rotații
Dacă rotația unei molecule în jurul unei axe date face ca o moleculă să fie identică cu molecula inițială, se spune că axa în cauză este o axă de rotație de ordinul n, desemnată prin simbolul C n . De exemplu, cu trifluorură de bor (BF 3 ), axa perpendiculară pe planul molecular este o axă C 3 . Această axă generează trei operații de rotație: C 3 , C 3 2 și C 3 3 = E (elementul neutru, vezi mai jos).
Dacă o moleculă are mai multe axe de rotație, cea mai mare axă de ordine se numește axa principală . Cu trifluorura de bor, axa C 3 este axa principală de rotație. Există, de asemenea, trei axe C 2 echivalente, una pe fiecare legătură B - F, deoarece rotirea cu 180⁰ în jurul unei legături care trece printr-un F schimbă doar celelalte două F.
Într-o moleculă liniară precum HCl sau HC≡CH, axa moleculară este o axă de ordin infinit C ∞ , deoarece există un număr infinit de unghiuri de rotație care fac moleculele identice cu molecula inițială.
Reflecții
Reflecția unei molecule într-un plan se numește operație de simetrie atunci când generează o copie similară a moleculei inițiale. În acest caz, planul de reflecție este elementul de simetrie numit plan de simetrie sau plan oglindă și desemnat prin simbolul σ (sigma = s greacă, din cuvântul german Spiegel = oglindă).
Molecula de formaldehidă (H 2 CO) are două așa-numite planuri oglindă verticale (simbolul v) deoarece conțin axa de rotație (C 2 ) a moleculei. Planul desemnat σ v trece între cei doi hidrogeni, iar reflexia din acest plan schimbă cei doi hidrogeni unul pentru celălalt. Planul desemnat σ v 'conține cei doi hidrogeni, care nu sunt apoi deplasați prin reflexie în acest plan. Dacă o moleculă conține mai multe axe de rotație, așa-numitul plan vertical conține axa principală.
În alte molecule există un plan orizontal (σ h ) perpendicular pe axa principală. În BF 3, de exemplu, planul moleculei este σ h deoarece este perpendicular pe axa C 3 .
Inversiunea
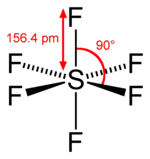
O moleculă are un centru de inversiune (prescurtat ca i ) sau un centru de simetrie dacă pentru fiecare atom din molecula din afara centrului, există un alt atom identic direct prin centru și la o distanță egală de centru. Într-adevăr, dacă centrul de simetrie este la originea coordonatelor, atomii identici se găsesc în punctele (x, y, z) și (−x, −y, −z). Operația de inversare implică mutarea fiecărui atom către atomul identic de cealaltă parte a centrului.
Poate fi sau nu un atom chiar în centru. De exemplu, hexafluorura de sulf (SF 6 ) este octaedrică și centrul său de inversiune este la atomul de sulf, în timp ce benzenul (C 6 H 6 ) este hexagonal în plan, iar centrul său de inversare este la centrul inelului unde nu se găsește niciun atom .
Rotații necorespunzătoare
În unele molecule combinația (denumită produs) a unei rotații C n și reflexia într-un plan perpendicular pe această axă poate fi o operație de simetrie, chiar dacă rotația singură sau reflexia singură nu sunt operații de simetrie. În acest caz, operația de simetrie se numește rotație-reflexie sau altfel rotație necorespunzătoare (simbol S n ).
De exemplu, legătura CC în etan nu este axă de simetrie C 6 (deși este axă C 3 ), iar planul perpendicular σ h de această legătură în centrul său nu este nici plan de simetrie. Cu toate acestea, produsul S 6 = σ h C 6 (sau altfel C 6 σ h ) este într-adevăr o operațiune de simetrie, deoarece aduce fiecare atom într-un atom echivalent. Axa S 6 generează operațiile S 6 , S 6 2 = C 3 , S 6 3 = S 2 = i, S 6 4 = C 3 2 , S 6 5 și S 6 6 = E.
O axă S 1 corespunde unui plan de reflecție (fără rotație), iar o axă S 2 corespunde unui centru de inversare. O moleculă tetraedrică precum metanul are trei axe S 4 .
Elementul neutru
Elementul neutru (sau elementul de identitate) al grupului este prescurtat E, din cuvântul german „Einheit” care înseamnă unitate. Fiecare moleculă are acest element, ceea ce nu modifică molecula. Deși acest element pare banal, trebuie inclus în setul de elemente de simetrie pentru ca acesta să fie un grup matematic , a cărui definiție necesită includerea elementului de identitate. Într-adevăr, este analog operației matematice a înmulțirii cu una, care nu schimbă numărul asupra căruia acționează.
Grupuri de simetrie
Grupuri în matematică
Operațiile de simetrie ale unei molecule (sau ale unui alt obiect) formează un grup . În matematică, un grup este un set cu o operație binară care satisface cele patru proprietăți ale grupului de mai jos.
Într-un grup de simetrie , elementele grupului sunt operațiile de simetrie (nu elementele de simetrie), iar combinația binară (sau produsul) a două elemente implică mai întâi aplicarea unei operații de simetrie și apoi alta. De exemplu, secvența unei rotații C 4 în jurul axei z urmată și reflectarea în planul xy este desemnată σ (xy) C 4 . Prin convenție, ordinea operațiilor este de la dreapta la stânga.
Un grup de simetrie respectă proprietățile care definesc orice grup:
(1) Proprietate de închidere : pentru fiecare pereche de elemente x și y din grupa G , produsul xy este, de asemenea, în același grup. Aceasta implică faptul că grupul este închis, astfel încât combinarea a două elemente nu produce niciun element nou. Operațiile de simetrie au toate această proprietate, deoarece secvența a două operații trebuie să producă o a treia stare care nu se distinge de a doua stare și apoi și de prima stare, astfel încât efectul net asupra moleculei să fie întotdeauna o operație de simetrie.
(2) Associative : Pentru fiecare x și y și z în grupa G , cele două combinații triple ( x y ) z și x ( y z ) dau același element în G . Adică, ( x y ) z = x ( y z ) pentru toate x , y și z ∈ G .
(3) Existența unui element neutru . Orice grup G trebuie să aibă un element neutru (sau un element de identitate) E astfel încât produsele lui E cu orice element x din G să lase elementul neschimbat: xE = Ex = x. Pentru un grup de simetrie moleculară, elementul neutru este să lase orice atom în poziție neschimbat.
(4) Existența unui invers al fiecărui element. Pentru fiecare element x în G , există un element invers y astfel încât xy = yx = E . De exemplu, inversarea unei rotații într-o direcție dată este o rotație cu același unghi, dar în cealaltă direcție.
Ordinea unui grup este numărul de elemente din grup.
Grupuri punctuale de simetrie
Aplicația consecutivă (numită compoziția a două sau mai multe operații de simetrie ale unei molecule corespunde unei singure operații de simetrie. De exemplu, o rotație C 2 urmată de o reflecție σ v este echivalentă cu reflecția σ v '. Aceasta este scrisă σ v * C 2 = σ v ', unde prin convenție operația care se efectuează mai întâi este scrisă în dreapta. Ansamblul tuturor operațiilor de simetrie a moleculei (inclusiv compozițiile) respectă toate proprietățile unui grup.
Se spune că acest grup este grupul de simetrie punctuală a moleculei. Cuvântul punctual implică faptul că setul de operații de simetrie lasă cel puțin un punct fix în spațiu. (Pentru unele operații, o întreagă axă sau un plan întreg rămâne fix.) Grupul de puncte include toate operațiile care lasă acel punct fix. Pe de altă parte, simetria unui cristal este descrisă de un grup spațial care include și operații de translație în spațiu.
Exemple de grupuri de simetrie punctuală
Atribuirea unui grup punctual fiecărei molecule clasifică moleculele în categorii cu proprietăți similare de simetrie. De exemplu, PCl 3 , POF 3 , XeO 3 și NH 3 au toate același set de șase operații de simetrie. Toți pot suferi elementul neutru E, două rotații diferite C 3 și trei reflexii diferite σ v fără a-și schimba geometria, deci toate au același grup punctual de ordinul 6 numit C 3v .
De asemenea, apa (H 2 O) și hidrogen sulfuri (H 2 S) împărtășesc , de asemenea , operațiuni identice de simetrie. Amândoi suferă elementul neutru E, o rotație C 2 și două reflexii σ v și σ v '. Acest set corespunde grupului de puncte C 2v de ordinul 4.
Diagrama de flux ne permite să identificăm grupul punctual de simetrie al marii majorități a moleculelor. Acest sistem de clasificare îi ajută pe oamenii de știință să studieze moleculele mai eficient, deoarece moleculele de natură chimică similară și de același grup de simetrie au în general seturi de legături similare și proprietăți spectroscopice similare.
Tabelul grupurilor de puncte
Acest tabel oferă o listă a grupurilor de puncte comune denumite în funcție de notația Schoenflies utilizată în chimie și spectroscopie moleculară. Structurile prezentate includ formele comune ale moleculelor, care pot fi adesea explicate prin teoria VSEPR .
| Grup de puncte | Operații de simetrie | Descriere simplă a geometriei tipice | Exemplul 1 | Exemplul 2 | Exemplul 3 |
| C 1 | E | fără simetrie, chiral |
 bromoclorofluormetan ( indicați doi enantiomeri ) |
 Acid lizergic |
 L-leucina și majoritatea celorlalți alfa-aminoacizi, cu excepția glicinei |
| C s | E σ h | plan oglindă, nicio altă simetrie |
 clorură de tionil , SOCl 2 |
 acid hipocloros |
 cloroiodometan |
| C i | E i | centru de inversiune |
 Acid mezotartaric |
( S , R ) 1,2-dibromo-1,2-dicloroetan ( anti conformer ) | |
| C ∞v | E 2C ∞ Φ ∞σ v | liniar |
 fluorură de hidrogen (și orice altă moleculă diatomică heteronucleară) |
 oxid de azot |
 acid cianhidric |
| D ∞h | E 2C ∞ Φ ∞σ i i 2S ∞ Φ ∞C 2 | liniar cu centrul de inversiune |
 dioxigen (și orice altă moleculă diatomică homonucleară) |
 dioxid de carbon |
 acetilenă (etină) |
| C 2 | CE 2 | „geometrie de carte deschisă”, chiral |
 apă oxigenată |
 hidrazină |
 tetrahidrofuran (conformație răsucită) |
| C 3 | CE 3 | elice de aer , chirale |
 trifenilfosfină |
 trietilamină |
 Acid fosforic |
| C 2h | EC 2 i σ h | plan cu centru de inversiune, fără plan vertical |
 trans - 1,2-dicloroetena |
 trans - difluorură de dinitrogen |
 trans - azobenzen |
| C 3h | EC 3 C 3 2 σ h S 3 S 3 5 | elice aeriene |
 acid boric |
 floroglucinol (1,3,5-trihidroxibenzen) |
|
| C 2v | EC 2 σ v (xz) σ v '(yz) | unghiular (unghiular) (H 2 O) sau basculant (SF 4 ) sau în formă de T (ClF 3 ) |
 apă |
 tetrafluorură de sulf |
 trifluorură de clor |
| C 3v | E 2C 3 3σ v | piramida trigonală |
 amoniac |
 Triclorură de fosforil , POCl 3 |
 Hidrocarbonil de cobalt , HCo (CO) 4 |
| C 4v | E 2C 4 C 2 2σ v 2σ d | piramidală cu baza pătrată |
 oxitetrafluorură de xenon |
 pentaboran (9) , B 5 H 9 |
 anion nitroprusid [Fe (CN) 5 (NO)] 2− |
| C 5v | E 2C 5 2C 5 2 5σ v | scaun |
 Ni (C 5 H 5 ) (NU) |
 corannulene |
|
| D 2 | EC 2 (x) C 2 (y) C 2 (z) | chiral răsucit |
 bifenil ( conformer stâng ) |
 twistane (C 10 H 16 ) |
Ciclohexan: conformator pentru bărci răsucite |
| D 3 | EC 3 (z) 3C 2 | triplu helix, chiral |
 cation tris (etilendiamină) cobalt (III) |
 fier (III) tris (oxalato) anion |
|
| D 2h | EC 2 (z) C 2 (y) C 2 (x) i σ (xy) σ (xz) σ (yz) | plan cu centru de inversiune și planuri verticale |
 etilenă |
 pirazină |
 diborane |
| D 3h | E 2C 3 3C 2 σ h 2S 3 3σ v | planul trigonal |
 trifluorură de bor |
 pentaclorură de fosfor |
 ciclopropan |
| D 4h | E 2C 4 C 2 2C 2 '2C 2 " i 2S 4 σ h 2σ v 2σ d | plan pătrat |
 tetrafluorură de xenon |
 anion octaclorodimolibdat (II) |
 Trans - [Co III (NH 3 ) 4 Cl 2 ] + (atomi de H excluși) |
| D 5h | E 2C 5 2C 5 2 5C 2 σ h 2S 5 2S 5 3 5σ v | pentagonal |
 anion ciclopentadienil |
 Rutenocen |
 C 70 |
| D 6h | E 2C 6 2C 3 C 2 3C 2 '3C 2 ' ' i 2S 3 2S 6 σ h 3σ d 3σ v | hexagonal |
 benzen |
 bis (benzen) crom |
 coronen (C 24 H 12 ) |
| D 7h | EC 7 S 7 7C 2 σ h 7σ v | heptagonale |
 Ion tropiliu (C 7 H 7 + ) |
||
| D 8h | EC 8 C 4 C 2 S 8 i 8C 2 σ h 4σ v 4σ d | octogonal |
 Anion ciclooctatetraenid ( anion C 8 H 8 2− ) |
 uranocen |
|
| D 2d | E 2S 4 C 2 2C 2 '2σ d | răsucite la 90 ° |
 allene |
 tetrasulfur tetranitridă |
 diboran (4) (stare excitată) |
| D 3d | E 2C 3 3C 2 i 2S 6 3σ d | răsucite 60 ° |
 etan ( conformație eșalonată ) |
 dicobalt octacarbonil (izomer nebridat ) |
 ciclohexan în conformarea scaunului |
| D 4d | E 2S 8 2C 4 2S 8 3 C 2 4C 2 '4σ d | răsucite la 45 ° |
 ciclooctasulfur (S 8 ) |
 Decacarbonil dimanganez ( rotamer deplasat) |
 ion octafluoroxenat (geometrie ideală) |
| D 5d | E 2C 5 2C 5 2 5C 2 i 2S 10 3 2S 10 5σ d | răsucite 36 ° |
 ferocen (rotamer deplasat) |
||
| S 4 | E 2S 4 C 2 |
 1,2,3,4-tetrafluorospiropentan |
|||
| T d | E 8C 3 3C 2 6S 4 6σ d | tetraedru |
 metan |
 pentoxid de fosfor |
 adamantane |
| O h | E 8C 3 6C 2 6C 4 3C 2 i 6S 4 8S 6 3σ h 6σ d | octaedric sau cubic |
 hexafluorură de sulf |
 Hexacarbonil de molibden |
 cubanez |
| Eu h | E 12C 5 12C 5 2 20C 3 15C 2 i 12S 10 12S 10 3 20S 6 15σ | icosaedrică sau dodecaedrică |
 Buckminsterfullerene (C 60 ) |
 dodecaborează anion |
 Dodecaedru |
Note și referințe
- Alain Sevin și colab., Chimie generală - întregul curs în dosare , Dunod,2012, p. 16-17
- Brian Pfennig , Principiile chimiei anorganice , Wiley, 191 p. ( ISBN 978-1-118-85910-0 )
- Brian Pfennig , Principiile Inorganic Chemistry , Wiley ( ISBN 978-1-118-85910-0 )
- Gary Miessler , Chimie anorganică , Pearson,2004( ISBN 9780321811059 , citit online )
- Gary L. Miessler , Chimie anorganică , Prentice-Hall,1999, A 2-a ed. , 621-630 p. ( ISBN 0-13-841891-8 )
- Model: Housecroft3rd
