Oxid de litiu
| Oxid de litiu | |
| |
| Identificare | |
|---|---|
| Sinonime |
litiu, oxid de litiu |
| N o CAS | |
| N o ECHA | 100.031.823 |
| N o EC | 235-019-5 |
| Aspect | pudra |
| Proprietăți chimice | |
| Formula brută |
Li 2 O [izomeri] |
| Masă molară | 29,881 ± 0,004 g / mol Li 46,46%, O 53,54%, |
| Proprietăți fizice | |
| T ° fuziune | 1.570 ° C |
| Solubilitate | Hidroliza violentă către LiOH |
| Masa volumică | 2013 kg · m -3 |
| Cristalografie | |
| Simbolul Pearson | |
| Clasa de cristal sau grup spațial | Fm 3 m (nr. 225) |
| Strukturbericht | C1 |
| Structura tipică | CaF 2 |
| Precauții | |
| WHMIS | |
 E, E : Materialul coroziv la contactul cu apa formează o substanță corozivă: hidroxid de litiu Divulgarea la 1,0% conform criteriilor de clasificare |
|
| Directiva 67/548 / CEE | |
 VS Simboluri : C : Fraze R corozive : R34 : Provoacă arsuri. Fraze S : S26 : În caz de contact cu ochii, clătiți imediat cu multă apă și solicitați sfatul medicului. S45 : În caz de accident sau dacă vă simțiți rău, solicitați imediat sfatul medicului (arătați eticheta acolo unde este posibil). S36 / 37/39 : Purtați îmbrăcăminte de protecție adecvată, mănuși și protecție pentru ochi / față. Expresii R : 34, Fraze S : 26, 36/37/39, 45, |
|
| Unități de SI și STP, cu excepția cazului în care se prevede altfel. | |
Oxid de litiu este un compus chimic cu formula Li 2 O. Este format cu cantități mici de hidroxid de litiu LiOH cand litiu arde metal în aer și se combină cu oxigenul și apa aerului:
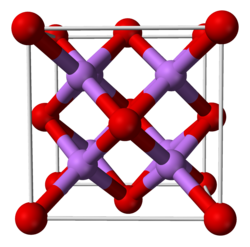
4 Li + O 2→ 2 Li 2 O 4 Li + 2 H 2 O + O 2 → 4 LiOHOxidul de litiu are în stare solidă o structură cristalină de tip antifluorină, adică o structură modelată pe cea a fluorurii de calciu CaF 2, dar în care cationii și anionii joacă rolul opus. În starea gazului de la sol, molecula Li 2 O este liniară, contrar rezultatelor prezise de teoria VSEPR (conform căreia molecula Li 2 O ar trebui să aibă aceeași formă ca molecula H 2 O ), care este în concordanță cu o geometrie guvernată de legături ionice.
Li 2 O rezultă din descompunerea termică a peroxidului de litiu Li 2 O 2și atacă silica la temperatură ridicată.
Referințe
- calculate în masă moleculară de „ masele atomice ale elementelor 2007 “ pe www.chem.qmul.ac.uk .
- " Structura fluoritului (C1) " , la http://cst-www.nrl.navy.mil/ (accesat la 17 decembrie 2009 )
- „ Oxid de litiu ” în baza de date cu produse chimice Reptox a CSST (organizația din Quebec responsabilă de securitatea și sănătatea în muncă), accesată la 25 aprilie 2009
