Hexasulfur
| Hexasulfur | |
| |
| Identificare | |
|---|---|
| Sinonime |
hexasulfur |
| ZÂMBETE |
S1SSSSSSS1 , |
| InChI |
InChI: InChI = 1S / S8 / c1-2-4-6-8-7-5-3-1 InChIKey: JLQNHALFVCURHW-UHFFFAOYSA-N |
| Aspect | solid sau lichid roșu-portocaliu |
| Proprietăți chimice | |
| Formula brută |
S 6 [Izomeri] |
| Masă molară | 192,39 ± 0,03 g / mol S 100%, |
| Proprietăți fizice | |
| T ° fuziune | 50−60 ° C |
| T ° fierbere | |
| Masa volumică | 2,209 g · cm -3 |
| Proprietăți electronice | |
| 1 re energie de ionizare | 10,2 eV |
| Cristalografie | |
| Sistem de cristal | Romboedrică |
| Structura tipică | . |
| Parametrii mesh | a = 10.818 Å , c = 4.280 Å , c / a = 0.3956 Å |
| Unități de SI și STP, cu excepția cazului în care se prevede altfel. | |
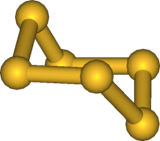
Hexasoufre , notat S 6 denumit în mod obișnuit cyclohexasoufre sau hexathiane este un allotrope de sulf roșu-portocaliu culoare. În fazele lichide și vapori, S 6 este ciclic în configurația scaunului și este în echilibru cu celelalte forme de sulf (în special S 8 ). Lungimea legăturii este de 2.057 Å . În formă solidă, structura sa cristalină este romboedrică . Acest compus este relativ stabil, deși la temperatura camerei și la presiunea atmosferică forma cea mai stabilă resturile S 8 . Se descompune în special în acesta din urmă și S 12 sub simplul efect al luminii. Energia sa de legare este de 62,8 kcal / mol. În S 6 (ca în S 8 ), atomii de sulf sunt toți echivalenți cu distanțe interatomice (d = 205,7 pm) și unghiuri constante (θ = 102,2 ° și θ diedru = 74,5 °). Adăugarea unui S la o unitate S 3 (pentru formarea lui S 6 ) are loc în conformația cis.
Pregătirea
Hexasulfurul a fost sintetizat pentru prima dată de Engel în 1891, prin reacția: H 2 S 4 + S 2 Cl 2 → S 6 + 2 HCI.
Note și referințe
- calculate în masă moleculară de „ masele atomice ale elementelor 2007 “ pe www.chem.qmul.ac.uk .
- http://web.gps.caltech.edu/~vijay/Papers/Chemistry/Meyer-76.pdf
- (en) NN Greenwood, Chimia elementelor , vol. 2, Butterworth Heinemann, Sulfur