Cancer mamar
Cancer mamar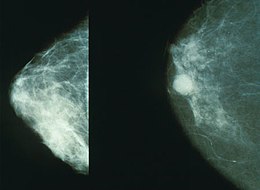 Mamografie care prezintă cancer mamar în dreapta.
Mamografie care prezintă cancer mamar în dreapta.
| Specialitate | Oncologie |
|---|
| CISP - 2 | X76 |
|---|---|
| ICD - 10 | C50 |
| CIM - 9 | 174 - 175 , V10.3 |
| OMIM | 114480 |
| BoliDB | 1598 |
| MedlinePlus | 000913 |
| eMedicină | 1947145, 345979 și 1276001 |
| eMedicină |
med / 2808 med / 3287 radio / 115 plastic / 521 |
| Plasă | D001943 |
| Medicament | Etinil estradiol , fluoximesteronă ( in ) , vinblastina , capecitabina , dexrazoxan , idarubicin , metotrexat , carboplatina , paclitaxel , mitoxantrona , vinorelbin , trastuzumab , anastrozol , toremifen ( in ) , letrozol , exemestan , epirubicina , docetaxel , tamoxifen , dietilstilbestrol , irinotecan , cisplatină , estradiol , ciclofosfamida , clorambucil , metiltestosteron ( in ) , melfalan , sargramostim ( in ) , leuprorelin , fulvestrant ( in ) , doxorubicină , ifosfamida , testolacton ( in ) , fluorouracil , aminoglutethimide ( in ) , megestrol ( în ) , goserelin acetat ( ro ) , nandrolonă , neratinib , tamoxifen , vinorelbină și eribulină |
| Pacient din Marea Britanie | Cancer de sân-pro |
Cancerul de sân este o tumoră malignă a glandei mamare . Cu alte cuvinte, este un cancer care începe în unitățile celulare a căror funcție este de a secreta lapte, unitățile ducto-lobulare ale sânului , în principal la femei . 8 din 10 tipuri de cancer mamar apar după vârsta de 50 de ani.
Primul cancer din lume, în 2016, afectează 1,8 milioane de femei pe an la nivel mondial, inclusiv 50.000 de femei în Franța. Una din opt femei este de așteptat să fie diagnosticată cu cancer de sân în viața ei. Tratamentul cancerului de sân sa îmbunătățit dramatic de-a lungul anilor, ducând la mai multe cazuri de remisie.
5-10% dintre aceste tipuri de cancer au o origine genetică ereditară; 85-90% din cazuri (așa-numita formă sporadică sau non-ereditară ) au origini de mediu sau necunoscute. O proporție semnificativă a cancerului de sân sporadic este indusă prin administrarea de hormoni, estrogeni și progesteron conținuți în contraceptive sau tratamente împotriva menopauzei. Factorii de risc sunt și consumul de alcool , zahăr, produse lactate, grăsimi hidrogenate , obezitate , lipsa activității fizice. O primă sarcină târzie și absența alăptării promovează, de asemenea, acest cancer.
Tratamentul va apela, conform protocoalelor, la chirurgie, radioterapie, chimioterapie, combinația acestor tratamente poate fi completată de terapia hormonală.
Epidemiologie
Riscul crește semnificativ odată cu vârsta cuprinsă între 30 și 60 de ani; este apoi omogen între 60 și 80 de ani; vârsta medie a diagnosticului este de 61 de ani.
Există anumiți factori genetici predispuși, precum și factori hormonali.
Trebuie remarcat faptul că incidența a scăzut semnificativ (cu puțin sub 9%) în Statele Unite din 2003 și, de asemenea, în Franța, ceea ce ar corespunde unei utilizări mai scăzute a terapiei de substituție hormonală pentru menopauză .
În 2002 , au fost evaluate aproape 1,1 milioane de cazuri noi, cu peste 400.000 de decese cauzate de cancer de sân. Incidența pare să crească constant, cu peste 1,6 milioane de cazuri noi în 2010 și 425.000 de decese. Aproape patru milioane de femei dezvoltă cancer de sân . Frecvența examinărilor histologice care seîncheie în „cancerul” mamar depinde mai ales de intensitatea screeningului (vezi supradiagnosticul ). Mortalitatea a scăzut semnificativ începând cu anii 1990 în țările dezvoltate. Ea continuă să crească în alte țări.
Cancerul de sân în Franța
Franța se numără printre țările în care incidența cancerului de san este foarte mare la nivel mondial, iar în cazul în care rata de incidență a cancerului mamar a crescut mai rapid (2,4 la 100 000 de femei pe an) pe parcursul perioadei 1980-2005, cu o picătură în această rată între 2000 și 2005 (+ 2,1 la 100.000 de femei pe an).
- Cancerul de sân a cauzat aproximativ 11.000 de decese în fiecare an în anii 2000, mortalitatea fiind stabilă (11.201 decese în 2005).
- Una din opt femei este afectată de cancerul de sân în Franța.
- Reprezintă mai mult de unul din 3 cazuri noi de cancer (36,7% în 2008) din toate cancerele noi, la femei.
- În anii 2000 , în fiecare an au fost diagnosticate aproximativ 50.000 de noi tipuri de cancer de sân.
- În 2005 , acest număr era de 49.814, ceea ce corespunde uneia dintre cele mai mari rate de incidență din Europa. Această rată a crescut în Franța cu 2,4% în medie pe an timp de 25 de ani (din 1980 până în 2005).
- Mai puțin de 10% din cancerele de sân apar înainte de 40 de ani, 25% apar înainte de 50 de ani, aproape jumătate înainte de 65 de ani.
- Aproape 10% dintre femei dezvoltă cancer de sân. 75% din cazurile noi depistate se referă la femei peste 50 de ani și acest număr este în continuă creștere: 35.000 în 1995 , 42.000 în 2001 .
Acest cancer face parte dintr-unul dintre cele trei tipuri de cancer pentru care supraviețuirea a crescut, deoarece rata de supraviețuire a crescut de la 80% la 87% la începutul anilor 2000, potrivit unui raport comun al Institutului pentru Supravegherea Sănătății Publice, rețeaua Francim. Institutul Național al Cancerului și Spitalele din Lyon.
Cancerul de sân în Asia de Est
Cancerul de sân în ChinaDintre femeile din China , cancerul de sân este cea mai frecventă și principala cauză de deces prin cancer. Mortalitatea prin cancer de sân a crescut în ultimii ani. Datele din a doua și a treia anchetă națională retrospectivă privind cauza morții din China estimează că mortalitatea prin cancer de sân a crescut între 1990-1992 și 2004-2005 de la 3,84 la 100.000 la 5,09 la 100.000 de locuitori. În 2008, au fost diagnosticate în jur de 169.000 de cazuri noi de cancer de sân și a fost cel mai frecvent diagnosticat tip de cancer la femeile din China. În același an, mortalitatea prin cancer de sân a fost de 5,7 la 100.000 de locuitori, rezultând aproximativ 44.900 de decese.
Cancerul de sân în JaponiaPotrivit unui studiu publicat în 2009, incidența cancerului de sân este istoric mult mai mică în Japonia decât în țările occidentale; între 1998-2002 în Osaka există o rată de 32,0 la 100 000 de femei, comparativ cu o rată de 105,6 la 100 000 de femei caucaziene în Hawaii și 107,5 la 100 000 de femei japoneze în Hawaii. Autorul observă consumul mai mare de alimente din soia în Japonia decât în țările occidentale și efectele sale asupra ratelor de cancer mamar din țară.
Factori de risc
Cancere sporadice (nefamiliare)
5-10% dintre cancerele de sân diagnosticate sunt cancere de sân predispuse genetic. Cancerele nefamiliare constituie restul de 90-95%. O treime dintre acestea, în țările occidentale, ar putea fi prevenită printr-o schimbare a stilului de viață.
Posibile mecanismeMulte molecule sau cocktailuri de molecule par a fi capabile să declanșeze sau să promoveze cancerul de sân; privind mecanismele implicate:
- O inhibiție a sistemului de răspuns la deteriorarea ADN - ului ar putea fi implicată în jumătate din cancerele de sân, în special în cele care sunt inițiate sau facilitate de hormonii utilizați pentru tratamentele hormonale ale menopauzei.
- O proteină ( Akt1 ) este supraexprimată în 50% din cazurile de cancer mamar sporadice. Prin urmare, ar putea predispune la cancer de sân și / sau poate fi implicat în alte procese (de mediu și non-genetice). Activarea AKT1 duce efectiv la inhibarea prin sechestrarea proteinei BRCA1 în citoplasmă ; totuși, dacă această proteină nu mai poate pătrunde și circula în nucleu, ADN-ul nu mai este reparat (ca în absența genei BRCA1 în cazul multor tipuri de cancer ereditar). AKT1 este, de asemenea, activat de hormoni suspectați de a provoca cancer de sân (cronic la femeile care urmează o terapie hormonală pe termen lung bazată pe estrogeni). În acest caz, gena BRCA1 nemutată poate fi perturbată, rezultând un risc crescut de cancer mamar.
- La fel o altă proteină; „Proteina kinază CK2” (o enzimă importantă pentru plasticitatea celulelor epiteliale ), pare a fi implicată în progresia acestor tipuri de cancer; alterarea activității acestei proteine este însoțită de o transformare a celulelor epiteliale în celule canceroase (mai mobile și o sursă de metastaze). Această proteină pare să împiedice în mod normal mecanismul celular numit „ Tranziție epitelială-mezenchimală ” (EMT; proces de evoluție a celulelor epiteliale către o stare mezenchimală și mobilitate, însoțită de rezistență la anumite medicamente anticanceroase ). Această enzimă combină două elemente; o „subunitate catalitică” (CK2α) și o „subunitate reglatoare” (CK2β). O disfuncție a subunității CK2β, care permite EMT, pare să fie implicată în producerea de metastaze pentru acest tip de cancer.
Cancerul de sân este adesea un cancer hormonal dependent: factorii care cresc nivelul de estrogen sunt, prin urmare, expuși riscului. Practic, riscul de cancer mamar crește odată cu numărul ciclurilor menstruale, indiferent dacă este artificial ( pilula estrogen-progestogen ) sau natural.
Terapia de substituție hormonală pentru menopauză crește semnificativ riscul de a dezvolta cancer de sân.
Menopauza târzie și pubertatea precoce funcționează prin creșterea numărului de cicluri menstruale și, prin urmare, a nivelului de estrogen. Factorii pubertății precoce sunt: obezitatea copiilor, consumul crescut de proteine animale (carne, lapte ), consumul de băuturi cu zahăr, expunerea la perturbatori endocrini .
Non-fertilitate sau fertilitate târzieFemeile care nu au avut copii sau care au avut prima sarcină târziu (după vârsta de 30 de ani) prezintă un risc semnificativ crescut de a dezvolta cancer de sân, comparativ cu cele care au avut cel puțin un copil înainte de vârsta de 30 de ani. De fapt, ciclurile premergătoare primei sarcini purtate până la termen par cele mai periculoase pentru sân. Sarcina protejează sânul prin schimbarea celulelor mamare în direcția unei diferențieri mai mari. Celulele diferențiate sunt mai puțin sensibile la agenții cancerigeni, în special la cele hormonale. Sarcina acționează, așadar, ca un vaccin împotriva estrogenilor. Cu cât apare mai devreme această primă sarcină, cu atât funcționează mai bine.
Poluanți și alți perturbatori endocriniSocietatea endocrine , într - o declarație scrisă de către experți internaționali, subliniază paralelismul dintre creșterea incidenței cancerului de sân în ultimii 50 de ani și proliferarea perturbatoare ale sistemului endocrin , produse chimice de sinteză cu acțiune estrogenică sau estrogenică. Cancerigenă. Aceste nenumărate produse (cele mai cunoscute fiind DES , DDT , Bisfenol A și dioxine ), din diverse surse ( pesticide , produse chimice industriale, materiale plastice și plastifianți , combustibili și alte substanțe chimice omniprezente în mediu), reprezintă o sursă majoră de îngrijorare pentru endocrinologi . Astfel, fetele care au fost extrem de expuse in utero în anii 1960 la DDT au un risc cvadruplu de cancer mamar, potrivit unui studiu publicat la mijlocul anului 2015. Mâncarea joacă un rol major.
Societatea endocrină emite o serie de recomandări vizate
- creșterea înțelegerii efectelor perturbatorilor endocrini (inclusiv prin cercetări de bază și studii clinice);
- invocați principiul precauției ;
- pledează pentru implicarea individuală și a societăților învățate pentru a face publică problema;
- face modificări legislative.
Din motive care nu sunt bine înțelese, obezitatea crește riscul de cancer mamar și, în special, de proliferarea rapidă a acestui cancer. Acest lucru a fost demonstrat in vivo , precum și in vitro ; astfel, atunci când celulele tumorale ( murine sau umane) sunt coculturate cu adipocite mature, acestea din urmă cresc capacitățile invazive ale cancerului. În general, obezitatea ar dubla riscul de cancer mamar.
Obezitatea, prin creșterea cantității de țesut gras, crește nivelul de estrogen din sânge prin activarea unei enzime numite aromatază . De fapt, aceasta transformă hormonii de tip androgen în estrogen . Acest lucru continuă după menopauză ; Un studiu a arătat riscul crescut de cancer mamar la femeile aflate în postmenopauză pe baza creșterii în greutate a acestora.
Adipocitele cultivate cu celule canceroase prezintă un fenotip modificat în ceea ce privește degresarea și o scădere a markerilor adipocitelor asociate cu activarea anormală caracterizată prin supraexprimarea proteazelor , în special a metaloproteinazei -11 și a citokinelor pro-inflamatorii ( interleukina-6 (IL-6) sau IL-1β.
În schimb, celulele tumorale ale cancerului de sân modifică celulele grase ( adipocite ) ale sânului. Acestea din urmă secretă în special factori proinflamatori , inclusiv interleukina 6 (care in vitro este suficientă numai pentru aceasta, determină metastazarea celulelor canceroase). Acest lucru ar putea explica de ce obezitatea crește riscul de metastază și răspândirea rapidă a acestui cancer. Rămâne să înțelegem factorii determinanți ai dialogurilor dintre celulele canceroase și adipocite, iar tumorile mai mari și / sau care implică ganglioni limfatici care contribuie prezintă niveluri mai ridicate de IL-6 în tumora din jur t adipocite.
Adipocitele peritumorale prezintă un fenotip modificat și caracteristici biologice suficient de specifice pentru a fi numite adipocite asociate cancerului (sau CAA pentru adipocite asociate cancerului ).
S-a dovedit că consumul de grăsimi animale, precum și cel al acizilor grași trans (care fac parte din compoziția multor preparate din industria alimentară) sunt factori de risc. Această relație între nivelul de grăsime animală ingerată și cancerul de sân este cunoscută de mult timp. Influența lipidelor polinesaturate este mai puțin evidentă
Un studiu (Inserm-Gustave-Roussy, 1995-1998) a arătat că riscul de cancer mamar crește cu aproape 50% la femeile cu un nivel ridicat al sângelui de acizi grași trans , produse care pot fi prezente în alimentele procesate, cum ar fi pâinea industrială și prăjituri, produse de patiserie, prăjituri, chipsuri, aluat de pizza.
LactateMai multe studii științifice mențin laptele ca factor de risc pentru cancerele dependente de hormoni, precum cele ale prostatei, ovarelor și sânului. Riscul crescut ar fi legat de creșterea nivelului de IGF-1 în sânge, în sine puternic corelat cu consumul de lapte. Legătura pare astfel stabilită în faza pre-menopauză și pare, de asemenea, în concordanță cu absența cancerului observată la populația cu sindrom Laron , care nu produce IGF-1 . Concentrația IGF-1 variază foarte mult în funcție de tipul de lapte (vacă, capră, oaie etc.), dacă este ușor sau de metoda de reproducere a rumegătoarelor ( somatotropină bovină ). Cu toate acestea, alte studii stabilesc mai degrabă un rol protector legat de conținutul de lapte în vitamina D și / sau calciu.
Consumul de alcool și tutunRiscul crescut și frecvența cancerului de sân sunt cel puțin parțial legate de creșterea consumului de alcool feminin;
- Numeroase studii au arătat că consumul de alcool (oricare ar fi acesta; vin , bere sau băutură tare ) crește riscul de cancer de sân. Acest risc este crescut în medie cu 30% pentru trei pahare de alcool pe zi. Metaanalizele au confirmat rolul alcoolului în geneza sau facilitarea cancerului de sân. Un studiu a constatat că acest risc a fost supraestimat, dar a fost respins printr-o meta-analiză bazată pe 98 de studii de caz-control și prospective.
- Riscul crește cu aproximativ 10% la 10 g de alcool suplimentar consumat în medie pe zi, cu sensibilități genetice diferite în funcție de individ, anumite subpopulații expuse la alți factori de risc cancerigeni pot fi, de asemenea, mai sensibili la acesta. Acest risc este agravat de alți factori: fiind peste 50 de ani, aflându-se în faza postmenopauză, fiind afectat de o boală benignă a sânului, o tumoare care implică receptori de estrogen și / sau tumori avansate / invazive.
- Acest risc se dublează cu consumul cronic de alcool (la femeile cu un indice de masă corporală normal (IMC <25), în timp ce obezitatea este un alt factor des citat).
- Consecințele alcoolului ca factor cancerigen sau cofactor asupra sânului ar putea fi destul de rapide, deoarece statisticile arată că impactul consumului recent este mai semnificativ decât cel al consumului vechi.
Există o corelație între fumat și apariția acestui cancer.
Lipsa vitaminei DVitamina D și analogii săi farmaceutici au proprietăți anti-proliferative și pro-diferențiere efecte. Prin urmare, este important pentru prevenirea și tratamentul cancerelor în general. Poate limita în special o producție excesivă de estrogen , acționând asupra aromatazei .
Cancerul de sân este adesea asociat cu niveluri scăzute de vitamina D (deficit sau insuficiență în 78% din cazuri, conform unui studiu realizat pe 145 de pacienți). Un exces de mortalitate prin cancer (inclusiv cancerul de sân) la afro-americani este atribuit pigmentării pielii, care blochează mai multe raze ultraviolete decât este necesar la aceste latitudini și împiedică semnificativ producția de vitamina D. Un studiu francez al evoluției pe parcursul a 10 ani a aproape 68.000 de femei a confirmat importanța legăturii dintre deficiența de vitamina D și apariția cancerului de sân. Analiza indicelui de expunere la UV la aceste femei a arătat că numai cei care au fost cei mai expuși la UV au obținut o protecție suficientă împotriva cancerului de sân pentru ca aportul alimentar să aibă un impact măsurabil; pentru toate celelalte, echipa INSERM concluzionează că, cu cât trăiești mai la nord, cu atât este mai dificil să atingi acest prag de vitamina D, care protejează împotriva cancerului de sân.
Este un termen vag pentru orice boală a sânului. În general, este rezervat pentru anomalii benigne care pot duce la confuzie cu o tumoare și pentru aceasta justifică o probă ( biopsie ) pentru a le identifica cu precizie. Unii pot promova cancerul ulterior și necesită o monitorizare regulată.
Un aspect dens pe mamografie, mai ales dacă este extins, ar crește semnificativ riscul de a dezvolta cancer de sân.
AlteDin punct de vedere istoric, a fost găsit la femeile care au suferit multe fluoroscopii atunci când tuberculoza pulmonară era foarte frecventă. Acest risc a fost detectat și la femeile japoneze care au fost iradiate la doze neletale în timpul exploziilor nucleare din Hiroshima sau Nagasaki . Acesta este, în esență, începutul secolului XXI de cazuri de radioterapie a pieptului în tratamentul anumitor tipuri de cancer - în special boala Hodgkin - la femeile tinere la care riscul de cancer mamar crește substanțial. Anumite noi modalități de examinare radiologică, cum ar fi scanarea CT coronariană , pot duce la suficientă iradiere pentru a crește riscul de cancer mamar decenii după efectuarea examinării.
Munca de noapte ar putea creste riscul de cancer de san. Acest risc a fost recunoscut legal în Danemarca și face obiectul unei compensații financiare.
Alăptarea acționează ca un protector împotriva cancerului de sân, în special prin adormirea ovarelor și reducerea numărului de cicluri.
Întreruperea sarcinii nu crește riscul de cancer mamar
În țările bogate (nu au existat studii în acest sens în altă parte), o înălțime peste medie la naștere este corelată cu un risc viitor de a dezvolta cancer de sân. Ar putea fi implicată expunerea fetală la anumiți hormoni implicați în creștere (care urmează să fie confirmată). 5% din cancerele de sân la femeile născute în țările dezvoltate sunt afectate direct.
La bărbați1% din cancerul de sân este dezvoltat de un bărbat. În aceeași etapă, prognosticul este identic. Cu toate acestea, glanda mamară la bărbați este foarte mică, diagnosticul este adesea târziu, deci există multe mai multe tipuri de cancer detectate într-un stadiu avansat, însoțite de afectarea pielii sau de planuri profunde (T4). Riscul de a contracta cancer de sân este crescut la bărbații cu antecedente familiale de cancer de sân, în special atunci când există o mutație în genele BRCA1 și BRCA2.
Cancerele familiale
5-10% dintre cancerele de sân diagnosticate sunt cancere de sân cu predispoziții genetice, adică între 2.000 și 4.000 de persoane afectate în fiecare an, cu 550 până la 1.000 de decese, în Franța. În 2008, zece gene au fost asociate cu un risc crescut de cancer mamar. Nouă sunt legate de sistemul de răspuns la deteriorarea ADN-ului. Al zecelea codifică o proteină care inhibă acțiunea enzimei AKT1 (o enzimă a cărei inhibare joacă, de asemenea, un rol în cancerele non-genetice). Două dintre aceste zece gene (cunoscute sub numele de BRCA1 și BRCA2) sunt singure responsabile de jumătate din aceste tipuri de cancer predispuse genetic, sau 2,5 până la 5% din toate tipurile de cancer de sân.
CaracteristiciCel mai adesea, acest tip de cancer mamar apare la o femeie fără nicio problemă specială de sănătate. Foarte rar, femeia este purtătoare a unei boli genetice cunoscute.
Mai multe semne pot sugera cancer de sân cu predispoziție genetică :
- Vârsta tânără (în medie 43 de ani în loc de 60 de ani în forme netransmisibile);
- Antecedente familiale de cancer mamar;
- Cancerele care apar la ambii sâni succesiv sau simultan;
- Apariția unui al doilea cancer în ovar ;
- Tipul histologic medular al cancerului.
Este de tip autosomal dominant . La o femeie, prezența unei singure mutații a genei expune un risc de 80% de a dezvolta cancer de sân (în loc de 10% în absența unei mutații).
Riscul pe care îl au femeile dintr-o familie în care există o genă anormală depinde dacă au moștenit-o sau nu. Dacă gena moștenită nu este anormală, riscul este același cu cel al altor femei; dacă gena este mutată, vor avea 70% până la 80% șanse de a face cancer de sân. Problema este similară pentru riscurile de cancer ovarian sau de colon . În unele familii, aceste tipuri de cancer pot fi observate în linie directă (bunica, mama, fiica) sau la rudele apropiate (mătușă, soră, văr primar). Aceste tipuri de cancer apar de obicei în prima parte a vieții lor.
Un test genetic poate evidenția acest risc, dar un test pentru o genă mutantă este sigur doar dacă este pozitiv (în acest caz, toate rudele ar trebui urmărite). Acest act foarte specializat ar trebui solicitat doar pentru familiile ale căror soții sunt susceptibile să prezinte o ereditate la risc, demonstrată printr-o consultație oncogenetică care va stabili arborele genealogic al acestei familii.
Gene implicatesunt identificate mai multe gene, dar cele două principale sunt:
- BRCA1 pe cromozomul 17 . Au fost deja descrise mai mult de 500 de mutații sau variații ale secvenței.
- BRCA2 pe cromozomul 13 . Au fost numărate peste 100 de mutații diferite.
Doar o parte din toate aceste mutații cresc factorul de risc pentru cancer. De mutații ale BRCA2 (1 în 1460) , se găsesc mai frecvent decât mutațiile BRCA1 (1 in 1960). Aceste mutații provoacă, pe lângă riscul excesiv de cancer de sân, un exces de risc de cancer ovarian.
Probabilitatea de a dezvolta cancer de sân într-un purtător al unei mutații BRCA1 este de aproximativ 65% înainte de vârsta de 70 de ani (45% pentru purtătorii unei mutații BRCA2 ).
Evoluția cancerelor care poartă mutații BRCA1 este încă slab înțeleasă: agravarea conform unora, pentru alții, severitate similară pentru purtătorii de mutații BRCA2 sau non-purtători de mutații.
Prevalența acestor mutații rămâne scăzută la pacienții cu cancer de sân (mai puțin de 4% pentru BRCA1 , deși este dublă la evreii askenazi).
Celelalte gene în cauză sunt PALB2, care este implicat în stabilizarea BRCA2 , ATM , CHEK2 , RAD51C , BARD1 sau TP53 .
Consiliere geneticăÎn unele țări, orice femeie care dorește să facă acest lucru poate beneficia de consiliere genetică pentru a-și determina riscul de cancer ereditar. Dacă probabilitatea predispoziției genetice este mai mare de 25%, acestor pacienți li se oferă un diagnostic molecular. Această cercetare moleculară este deosebit de predictivă dacă cunoaștem mutația la un părinte care suferă deja de cancer mamar cu predispoziție genetică.
Supravegherea femeilor cu risc ridicatFemeile cu risc de predispoziție genetică sau purtătoare de mutație sunt monitorizate de echipe de supraveghere clinică la fiecare 6 luni de la vârsta de 20 de ani și prin mamografie anuală de la vârsta de 30 de ani . Printre factorii de creștere a riscului se numără existența carcinomului ductal in situ , considerat a fi o formă precanceroasă, și carcinomul lobular in situ , care este mai ușor, dar se poate dezvolta în cancer în 20-30% din cazurile identificate.
Screening
Detectarea și tratarea tumorilor atunci când acestea sunt foarte mici (mai puțin de un centimetru în diametru) este posibilă datorită mamografiei și monitorizării periodice. Acest lucru reduce riscul de mortalitate și permite tratamente mai puțin grele și mai puțin traumatice decât chimioterapia , operația de „mutilare” (ablație). Între 50 și 74 de ani femeile sunt cele mai expuse la acest tip de cancer. O mamografie la fiecare doi ani permite screening-ul eficient, dar care expune un risc de supradiagnostic corespunzător unui fals pozitiv : femeia este considerată a avea cancer mamar atunci când nu este, expunându-l astfel la un tratament nejustificat cu toate efectele secundare și riscurile care urmează. Avantajul acestui screening trebuie, prin urmare, să fie documentat cu atenție. Conform unei meta-analize din 2003, o reducere semnificativă a mortalității prin screening poate fi demonstrată în unele cazuri; cu toate acestea, aceeași meta-analiză raportează alte două studii concurente care nu arată nicio reducere semnificativă. Cu toate acestea, această existență a reducerii riscurilor este criticată.
În Franța, o structură de management departamentală sau interdepartamentală trimite tuturor femeilor cu vârsta cuprinsă între 50 și 75 de ani o invitație pentru o mamografie gratuită (sprijin financiar 100% din partea Asigurărilor Sociale) la fiecare doi ani. Invitația poate fi trimisă la cererea medicului generalist , a ginecologului sau a femeii însăși. Vizita trebuie făcută la un radiolog acreditat, membru al rețelei specializat în screening-ul înființat la nivelul departamentelor. Această strategie se bazează în special pe un raport de experți întocmit în 2001-2 de către Departamentul de Evaluare a Tehnologiei al Agenției Naționale pentru Evaluare și Acreditare a Sănătății. Obiectivul declarat al acestui raport a inclus o reamintire a recomandărilor franceze în vigoare. Raportul a concluzionat că, din moment ce ineficiența mamografiei de screening nu a fost dovedită, recomandările de utilizare pentru screeningul cancerului de sân ar trebui menținute.
O ecografie asociată cu mamografia poate detecta un număr mai mare de cancer, dar este asociată cu un număr mai mare de fals pozitivi (biopsia invalidând diagnosticul de cancer). Prin urmare, locul acestei examinări în strategia de screening rămâne de evaluat.
Imagistica prin rezonanta magnetica (IRM) ar fi , de asemenea , un test de promitatoare , cu o sensibilitate mai mare decat mamografie.
Auto - examen a fost o tehnica de screening foarte popular în anii 1980 și 1990, care a fost încă recomandată , dar nu a fost dovedit a fi eficiente.
Utilizarea termografiei în infraroșu, pentru detectare, este o examinare cu mai puține efecte secundare (fără radiații), cu o sensibilitate mai bună , mai puțini falsi pozitivi și o detectare mai timpurie decât mamografia. Costul termografiei ar fi, de asemenea, semnificativ mai mic decât cel al screening-ului prin mamografie, al cărui buget anual este de 250 de milioane de euro. Cu toate acestea, în 2017, termografia a fost folosită cu greu în Franța. Tehnica și-a arătat simplitatea printr-o știre.
După 75 de ani, beneficiul screening-ului sistematic nu a fost demonstrat. Se pare că este slab între 70 și 75 de ani. Înainte de vârsta de 50 de ani, interesul este discutabil, fără o scădere dovedită a mortalității.
Supradiagnostic
Înainte de menopauză , screening-ul sistematic nu s-a dovedit eficient deoarece sunt frecvente anomalii suspecte minime. Dezavantajele în acest caz par să depășească avantajele, cu excepția femeilor cu risc.
Riscul de screening sistematic este acela de a face un diagnostic incorect și de a conduce la un tratament nejustificat, cu un cost și un risc ca urmare. Aceasta se numește supradiagnostic . În cancerul de sân, mamografia poate duce la o rată semnificativă de supradiagnostic. Această proporție ar putea varia de la unul din zece la unul din patru sau chiar unul din doi. Raportul dintre numărul de vieți salvate și numărul de femei cu un diagnostic excesiv (care reflectă parțial ceea ce se numește raportul beneficiu / risc al unei examinări) poate varia astfel de la 1 la 2 la 1 la 10.
Explicația pentru aceste supra-diagnostice nu este fără echivoc: interpretarea greșită a documentelor, cancerele cu evoluție foarte lentă sau chiar regresia spontană a anumitor tumori maligne.
Cu toate acestea, potrivit departamentului de boli cronice al Institutului Francez de Supraveghere a Sănătății Publice , aceste analize ar trebui, în viitor, să facă posibilă screeningul și mai eficient, cu scopul de a identifica cancerele care vor evolua din cele care vor rămâne latente, fără a pune sub semnul întrebării beneficiul screeningului în sine.
Sâni densi
Pentru sânii densi sau extrem de densi, o mamografie poate fi ineficientă pentru a putea detecta cancerul. Studiile au măsurat că mamografiile nu reușesc să găsească cancer în aproape o treime până la jumătate din cazurile de femei cu sâni densi .
Țesutul mamar dens interferează cu capacitatea de a găsi cancer cu o mamografie. Acționând ca un nor, țesutul dens al sânului este alb și poate masca cancerul care pare, de asemenea, alb.
Densitatea sânilor poate fi măsurată prin BI-RADS utilizând un sistem de scor 1-4. Acest sistem permite radiologilor să măsoare și să descrie densitatea sânilor
BI-RADS 1: țesut mamar dens <25% BI-RADS 2: țesut mamar dens între 26 și 50% BI-RADS 3: țesut mamar dens între 51 și 75% BI-RADS 4: țesut mamar dens> 75%
Aproape jumătate dintre femeile din Statele Unite au sâni densi. În unele state, radiologii au obligația legală de a oferi femeilor densitatea sânilor, astfel încât să poată purta o conversație informată cu echipa lor medicală despre ce teste suplimentare ar putea avea nevoie.
Cinci fapte despre țesutul dens din sân:
. 40% dintre femei au sani densi. . densitatea sânilor este unul dintre cei mai fiabili predictori ai ineficienței mamografiei la detectarea cancerului existent. . mamografia nu detectează un cancer existent într-o treime până la jumătate din cazuri, conform studiilor, pentru sânii densi. . Densitatea sânilor este un predictor bine stabilit al riscului de cancer mamar. . densitatea mare a sânilor este un factor de risc mai mare decât a avea două rude de gradul I cu cancer de sân.
O ecografie combinată cu o mamografie poate detecta un număr mai mare de tipuri de cancer pentru sânii densi și hiper-densi. La ultrasunete, unele tipuri de cancer de sân par negre și, prin urmare, pot fi detectate. O ecografie mamară nu este suficientă singură pentru depistarea cancerului de sân.
Un alt tip de scanare este RMN.
Un alt tip de analiză s-a dezvoltat în Statele Unite pentru a depăși ineficiența mamografiilor pentru screeningul cancerului pentru sânii densi. Imaginea moleculară a sânului (MBI) este un instrument de diagnostic secundar extrem de eficient .
Chiar și cu un rezultat de mamografie negativ pentru femeile cu sâni densi (sau care sunt considerate cu risc crescut de cancer de sân), ar trebui luate în considerare testarea MBI suplimentare.
O imagine MBI reprezintă o analiză funcțională moleculară activă a țesuturilor datorită luării unui radio-trasor injectat în vene. În aceste imagini, țesutul sănătos, dens sau nu, apare în negru și țesutul bolnav apare în alb, datorită absorbției mai rapide a razelor gamma conținute în mufa radio-trasorului.
Diagnostic
Clinic
Palparea sânului este prima examinare care trebuie efectuată. Datorită localizării lor anatomice, sânii sunt ușor de simțit, mai ales atunci când sunt de dimensiuni medii sau mici. Se recomandă ca pacienții să efectueze ei înșiși acest test de rutină la sfârșitul menstruației.
În timpul palpării, suspiciunea se face din descoperirea unui nodul , care poate fi detectat prin palpare de la aproximativ 1 cm în diametru. Este posibil ca neregularitatea să nu fie dureroasă, dar orice anomalii recente ar trebui să atragă în special atenția pacientului și a medicului ei.
Printre neregulile pe care pacientul le poate urmări singure:
- o gropiță sau un rid care scobesc suprafața sânului cu aspect de „coajă de portocală”;
- o deformare a mamelonului , retragându-l spre interior;
- un aspect eczematos al mamelonului care devine roșu, crust sau erodat;
- scurgerea mamelonului, mai ales dacă este sângeroasă sau negricioasă.
Observarea unuia dintre aceste semne ar trebui să ducă la un consult medical foarte rapid. Cu toate acestea, numai medicul va putea judeca ce examinări suplimentare sunt necesare, deoarece toate aceste semne nu se găsesc doar în cazul cancerelor. Un nodul poate fi de natură benignă:
- atunci când este solid în consistență, poate fi un adenofibrom care s-a dezvoltat în glanda mamară. Aceasta se poate dezvolta datorită unui mediu bacterian specific, care se poate transforma sau nu mai târziu în adenocarcinom .
- atunci când are o natură lichidă, poate fi un chist .
Mamografie
Medicul poate decide să i se confirme primul diagnostic printr-o mamografie . Ecografie este un examen complementar care poate ajuta la localizarea defecțiunii , pentru a facilita îndepărtarea sau recunoaște dacă acesta este un chist plin cu lichid, dar nu poate înlocui mamografia. Mamografia, efectuată în mod regulat și ca parte a programelor de screening , poate diagnostica boala într-un stadiu suficient de timpuriu pentru ca tratamentul să fie cât mai conservator posibil și în același timp eficient. De fapt, atâta timp cât dimensiunea tumorii este mai mică de 1-2 cm, șansele de recuperare sunt aproape de 100%.
Confirmarea diagnosticului
Dacă toate examinările încă nu fac posibilă asigurarea unui diagnostic bun și dacă persistă îndoielile, este necesar să se ia în considerare o probă luată cel mai adesea de un ac mare (trocar) sub anestezie locală fără spitalizare. Eșantionul sau biopsia se efectuează adesea sub un ghid cu ultrasunete sau radiologie; atunci vorbim de ultrasunete ghidate biopsie si biopsie stereotaxică a sânului. Diagnosticul de certitudine se va face prin studiul anatomopatologic a probei prelevate.
Evaluarea extensiei
Căutarea metastazelor este fundamentală în strategia de tratament a cancerului de sân. Dar, în ciuda numeroaselor studii efectuate sau a cunoașterii aprofundate a anumitor explorări, în prezent nu există nicio strategie validată pentru căutarea sistematică a metastazelor în cancerul de sân.
Majoritatea recomandărilor propun în prezent o prelungire, inclusiv radiografie toracică, ultrasunete hepatice și scintigrafie osoasă. Pentru tumorile foarte mici, această evaluare poate fi opțională. Pe de altă parte, pentru tumorile avansate (tumori inflamatorii, focale multifocale, invazie semnificativă a ganglionilor limfatici), riscul metastatic inițial este ridicat și poate justifica o evaluare mai aprofundată, incluzând o tomografie computerizată (CT) a întregului corp și RMN mamar .
Mărimea tumorii, existența limfadenopatiei metastatice, existența unei afectări a pielii sau a peretelui toracic sau a metastazelor la distanță fac posibilă stabilirea unei clasificări clinice a cancerelor de sân.
| Clasificarea TNM | Descriere |
|---|---|
| Tx | Tumora care nu poate fi evaluată prin lipsa de informații |
| T0 | Nu există dovezi ale tumorii primare |
| Tis | Carcinom ductal in situ sau carcinom lobular in situ sau boala Paget a mamelonului fără tumoră subiacentă |
|
T1 T1a T1b T1c |
Tumora mai mică de 2 cm în cea mai mare dimensiune - T <0,5 cm - T între 0,5 și 1 cm - T între 1 și 2 cm |
| T2 | Tumora mai mare de 2 cm și mai mică de 5 cm în dimensiunea sa cea mai mare |
| T3 | Tumora mai mare de 5 cm în dimensiunea sa cea mai mare |
|
T4 T4a T4b T4c T4d |
Tumora de orice dimensiune cu extensie: - la peretele toracic - edem sau ulcerație sau nodul de permeație a pielii - la piele și peretele toracic Cancer inflamator |
Diferite tipuri de cancer mamar și carcinom
Clasificarea OMS
Studiul anatomopatologic arată existența diferitelor tipuri de cancer mamar. Potrivit Organizației Mondiale a Sănătății , tabelul de mai jos prezintă clasificarea histologică a cancerelor de sân utilizate în toate centrele de cancer.
Ca și în orice epiteliale tumorale, exista sunt cancere in situ . Cea mai frecventă varietate de cancer de sân este de tip ductal .
| Tumori epiteliale neinfiltrante |
| Carcinom ductal in situ (intracanal) (DCIS) |
| Carcinom lobular in situ (LCIS) |
| Tumori epiteliale infiltrante |
| Carcinom ductal invaziv NOS (fără indicații suplimentare) |
| Carcinom ductal invaziv cu componentă intracanal predominantă |
| Carcinom lobular invaziv |
| Carcinom mucinos (coloid) |
| Carcinom medular |
| Carcinom papilar |
| Carcinom tubular |
| Carcinom chistic adenoid |
| Carcinom secretor juvenil |
| Carcinom apocrin |
| Carcinom metaplastic tip celule scuamoase |
| Carcinom metaplastic de tip celulă fusiformă |
| Carcinom metaplazic chondroid și osos |
| Carcinom metaplastic de tip mixt |
| Boala Paget a mamelonului |
Cancer inflamator
Cancerul de sân inflamator este o formă foarte rară de cancer de sân (1-4%) care se dezvoltă rapid în câteva zile sau săptămâni. Se răspândește rapid prin limfă fără a avea timp să formeze o tumoare. Blocarea vaselor limfatice de către celulele canceroase este cauza inflamației locale a sânului de importanță diferită. Diagnosticul de abces mamar este adesea menționat inițial, mai ales că imagistica (mamografie și ultrasunete) este adesea negativă. Orice persistență a unei roșii mai mult sau mai puțin dureroase a sânului necesită biopsii, care singure vor confirma boala. Tratamentul se bazează în principal pe chimioterapie, care progresele recente au permis vindecarea într-un număr mare de cazuri.
Clasificare histologică și moleculară
În contextul cercetării cancerului de sân, patru tipuri de cancer de sân se disting în principal în funcție de morfologia lor și de prezența a trei markeri moleculari: cel al receptorului de estrogen (ER) și supraexprimarea receptorului. Progesteron (PR) și Marker HER2 , acesta din urmă fiind un receptor de tip EGFR. Cele patru clase rezultate sunt:
- Bazal sau triplu negativ: ER- / PR- / HER2-
- HER2-supraexprimare: ER- / PR- / HER2 +
- Luminal A: ER + / PR + / HER2-
- Luminal B: ER + / PR + / HER2 +
Denumirea tipurilor bazale și luminale provine de la asemănarea tumorilor cu țesuturile epiteliale normale corespunzătoare sânului. În general, cancerele bazale și HER2 care supraexprimă au un prognostic clinic slab.
Studiile bazate pe utilizarea cipurilor de ADN în mod sistematic în cohorte de pacienți au reușit, de asemenea, să izoleze diferite semnături ale expresiei genelor, iar cancerele de sân de tip luminal tind să exprime gene și proteine GATA3 , KRT19 , apoi pe cele de tip bazal, pe de altă parte, nu le exprimați, dar printre altele ETS1 și CD44 .
Tratamente
Ca și în cazul tuturor tipurilor de cancer, este ideal (din punct de vedere medical) îndepărtarea chirurgicală a tumorii, ceea ce face posibilă punerea diagnosticului cu certitudine. Următoarea problemă este de a face evaluarea extensiei : prezența sau nu a ganglionilor limfatici afectați, prezența sau absența metastazelor.
Cu toate acestea, mutilarea sânilor corespunde, în general, pentru femei și mutilării psihologice și sociale, sânii fiind unul dintre cele mai puternice simboluri ale feminității. Unele femei pot experimenta această mutilare ca o negare a feminității lor și, prin urmare, a personalității lor.
Există, de asemenea, alte tratamente, cum ar fi chimioterapia , radioterapia și terapia hormonală , care, în unele cazuri, pot fi utilizate pentru a reduce tumora înainte de operație. Eficacitatea și riscurile fiecărui tip de tratament depind de tipul de cancer, de amploarea acestuia și de locul în care se află.
Strategia terapeutică
Există multe tratamente pentru cancerul de sân, dar acestea trebuie întotdeauna individualizate pentru un tratament optim. Astfel, analiza genomică a cancerului de sân ar dezvălui aproximativ cincizeci de tipuri diferite de cancer de sân, fiecare tip sau grup din care ar fi susceptibil unei terapii specifice.
Pentru cancerul de sân localizat, tratamentul are aproape întotdeauna un scop curativ. Se bazează pe cele patru arme terapeutice care sunt chirurgia, chimioterapia, radioterapia și terapia hormonală. Chirurgia este un pas esențial în vindecarea cancerului de sân, alte tratamente vizând de obicei doar reducerea riscului de recidivă. Prin urmare, acestea vor fi indicate dacă acest risc este semnificativ și dacă beneficiul presupus al tratamentului este suficient, deoarece toate aceste tratamente au efecte secundare. Prin urmare, beneficiul scontat trebuie cântărit cu riscul de complicații.
Pentru cancerul de sân metastatic: în acest stadiu de dezvoltare, este foarte rar să poți oferi un tratament curativ. Dar tratamentele moderne permit deseori extinderea supraviețuirii cu câțiva ani. Este imposibil să detaliați aici diferitele strategii terapeutice posibile, deoarece acestea depind de un număr foarte mare de factori. Tratamentul cancerului de sân metastatic începe cu chimioterapia și terapia hormonală. Tratamentul chirurgical sau radioterapic al siturilor metastatice poate fi luat în considerare fie în scop curativ, când toate siturile sunt accesibile tratamentului (de exemplu: metastaze hepatice sau vertebrale unice), fie în scopuri paliative (de exemplu: iradierea unui os dureros cu metastază).
Există o serie de markeri genetici care se corelează cu prognosticul cancerului de sân și, prin urmare, pot ghida tratamentul.
De markeri moleculari de severitate si prognosticul cancerului de san , de asemenea , există. Metalotioneina (MT) sunt una. Se leagă ușor de anumite metale și sunt codificate de cel puțin 10 gene funcționale MT care sunt asociate cu proliferarea celulelor cancerului de sân, în special a cancerelor de sân ductale invazive. Acest lucru face din TM un biomarker prognostic pentru cancerul de sân detectabil prin imunohistochimie . Cu cât sunt mai multe TM exprimate în cancerul de sân, cu atât este mai sever cancerul.
Unele tratamente (agenți alchilanți sau tamoxifen ) pot fi inhibate de supraexprimarea metalotioneinei (de exemplu la un pacient care a suferit otrăvire cu metale grele)
Interventie chirurgicala
Eliminarea tumoriiExistă trei tipuri de intervenții chirurgicale la sân: lumpectomia (îndepărtarea tumorii), segmentectomia (îndepărtarea unei părți a sânului) și mastectomia (îndepărtarea întregului sân).
În cazurile în care tumora este îngrijită suficient de devreme, este posibilă o intervenție chirurgicală minimă (chirurgie conservatoare). Uneori trebuie să îndepărtați întregul sân. Chirurgia reconstructivă se poate face în același timp sau secundar.
- Ilustrația chirurgiei reconstructive a sânului: recuperarea unei părți a mușchilor abdomenului ( restus abdominus ) pentru reconstrucția sânului, Institutul Național al Cancerului .
Această tehnică constă în îndepărtarea ganglionilor limfatici situați în golul axilar (la nivelul axilei). Această operație are multe efecte secundare, deoarece această ablație destabilizează rețeaua limfatică , ceea ce poate duce la apariția limfedemului (brațul mare). În scopul reducerii acestor efecte secundare a fost implementată tehnica nodului santinelă .
Tehnica nodului santinelăÎntr-o tumoare, nodul santinelă este primul care primește drenaj limfatic.
Ganglionul santinelă este identificat prin injectarea unui colorant, indiferent dacă este sau nu însoțită de un coloid radioactiv. Apoi este retras pentru a permite un studiu anatomopatologic. Dacă nodul studiat este sănătos, această tehnică elimină necesitatea disecției axilare (îndepărtarea aproape a tuturor nodurilor din regiune), ceea ce ar duce la sechele semnificative. Poate fi aplicat pacienților cu o tumoare mai mică de 3 centimetri și afectează până la 70% dintre aceștia.
Această tehnică este validată, cu o rată de eroare mai mică de 10%.
Prevenirea durerii postoperatoriiO reducere a riscului de durere cronică postoperatorie poate fi obținută prin efectuarea anesteziei locoregionale în momentul intervenției chirurgicale. La trei până la douăsprezece luni după intervenția chirurgicală pentru cancerul de sân, durerea cronică postoperatorie poate fi prevenită la una din șapte persoane ( numărul persoanelor care urmează să fie tratate ). Deși încurajatoare, aceste rezultate se bazează pe dovezi de nivel scăzut.
Monitorizare postoperareDupă tratamentul inițial, este esențial ca pacientul să fie monitorizat în mod regulat.
Nu sunt necesare mai multe examinări, dar mamografia bilaterală anuală este esențială, mai ales în cazul unei intervenții chirurgicale conservatoare. În funcție de caz, poate fi combinat cu alte examinări suplimentare definite în funcție de fiecare caz.
Chiar și cancerul de sân tratat optim poate reapărea local sau la distanță ( metastază ). Recurența poate apărea la ani după tratamentul inițial, de unde și importanța menținerii supravegherii.
Radioterapie
Reduce mortalitatea acestui cancer, dar necesită o tehnică ireproșabilă pentru a reduce iradierea țesuturilor sănătoase, ceea ce poate duce la un exces de mortalitate din patologia cardiovasculară. Se face distincția între radioterapia la nivelul sânului și a celor din zonele ganglionare. În cazul unei intervenții chirurgicale conservatoare, radioterapia trebuie efectuată întotdeauna, deoarece reduce semnificativ riscul de recurență locală. Radioterapia va fi cu atât mai importantă cu cât femeia este mai tânără. În cazul îndepărtării totale a sânilor, radioterapia este indicată, în anumite cazuri, pentru a reduce riscul de recurență locală. Iradierea lanțurilor ganglionare depinde de localizarea tumorii și de rezultatul examinării anatomo-patologice a ganglionilor.
Efecte secundare pe termen lungRiscul de mortalitate secundar radioterapiei în comparație cu cel al mortalității cardiovasculare nu pare să crească până în al treilea deceniu după tratament, potrivit unui studiu care a monitorizat peste 500.000 de femei.
Un studiu european privind riscurile pentru făt în contextul radioterapiei sau chimioterapiei pentru tratamentul cancerului a arătat că fetuții a căror mamă a fost tratată în timpul sarcinii nu ar avea mai multe defecte cardiace decât un copil neexpus.
Pentru a identifica riscurile fibrozei mamare induse de radioterapie, un test a fost dezvoltat de Inserm pentru a măsura „rata de apoptoză limfocitară indusă de radio (TALRI)”. Cu cât este mai mare nivelul TALRI, cu atât este mai mic riscul de fibroză mamară.
Chimioterapie
Acesta constă în administrarea de medicamente anti-cancer la intervale fixe, în general la fiecare 3 săptămâni. Numărul de cursuri de chimioterapie adjuvantă (chimioterapie efectuată după operație) pentru cancerul de sân este cuprins între 4 și 6. Avantajele chimioterapiei adjuvante față de tratamentul chirurgical fără chimioterapie sunt o reducere semnificativă a mortalității și o rată mai mică de recurență. În cazul afectării ganglionilor limfatici axilari, schema care combină 3 cicluri de chimioterapie cu antraciclină (Farmorubicin °) și ciclofosfamidă (Endoxan °), apoi 3 cicluri cu docetaxel (Taxotere °) este în prezent referința. Pentru cancerele fără invazie de ganglioni limfatici axilari, căutarea factorilor cu un prognostic slab care poate explica un rezultat nefavorabil (grad histologic ridicat, fără receptori hormonali, dimensiunea tumorii mai mare de 15 sau chiar 10 mm pentru unii etc.) face posibilă pentru a indica indicația „chimioterapiei adjuvante.
În cazul unei tumori avansate sau inflamatorii, este uneori necesar să începeți tratamentul cu chimioterapie ( chimioterapie neoadjuvantă ) pentru a reduce dimensiunea tumorii și, eventual, pentru a permite o intervenție chirurgicală conservatoare.
Chimioterapia neoadjuvantă este, de asemenea, utilizată pentru a limita dimensiunea exciziei: o lumpectomie este uneori suficientă atunci când a fost planificată inițial o mastectomie cu chimioterapie adjuvantă.
În această ultimă indicație, în timp ce mortalitatea generală, timpul până la agravarea bolii și rata recurenței la distanță nu sunt diferite de chimioterapia adjuvantă, recidivele locoregionale sunt mai frecvente. În prezent nu există un protocol standard de chimioterapie neo-adjuvantă.
Contra: oboseală generală, greață și vărsături, căderea temporară a părului. Acestea variază în funcție de produsele utilizate și sunt din ce în ce mai bine controlate.
O serie de produse s-au dovedit a fi eficiente în tratamentul adjuvant al cancerului de sân și au un protocol de referință, dar alte produse intră pe piață și / sau sunt studiate.
Terapii vizate
Trastuzumab a revoluționat tratamentul multor pacienți. Alte medicamente sunt evaluate. Aceste molecule sunt adesea caracterizate de o bună toleranță, totuși sunt produse deosebit de scumpe.
TrastuzumabUnele tipuri de cancer de sân supraexprimă semnificativ gena Her2 (aceasta se referă la aproximativ 25% din cazurile de cancer de sân, adesea cu un prognostic slab, deoarece Her2 - sau CerbB2 - este receptorul de membrană care face posibilă activarea uneia dintre căile pentru proliferarea celulară crescută). Celulele canceroase prezintă apoi o dependență oncogenă , fiind dependente pentru supraviețuirea lor de funcționarea căii de semnalizare indusă de Her2 . Aceasta este inhibată de trastuzumab (Herceptin °), un anticorp monoclonal care blochează acest receptor. Herceptin a fost folosit pentru prima dată într-o situație paliativă. În acest context, Herceptin a făcut posibilă, în medie, dublarea timpului de supraviețuire al acestor pacienți. Adăugată la chimioterapia adjuvantă, perfuzia cu Herceptin ° la fiecare 21 de zile timp de 12 luni reduce riscul de recidivă la pacienții cu HER2 + la jumătate și mortalitatea cu aproximativ o treime.
Din noiembrie 2017, Ontruzant, un medicament biosimilar al trastuzumab , a deținut prima autorizație de introducere pe piață emisă de Comisia Europeană , permițând distribuirea acestuia în Uniunea Europeană , precum și în Norvegia , Islanda și Liechtenstein .
BevacizumabÎn 2007 , bevacizumab ( Avastin ) a fost utilizat în cancerul de sân metastatic (autorizație de introducere pe piață în Franța în 2007, metastatic de primă linie). Este un anticorp monoclonal anti- VEGF , administrat prin perfuzie. Se leagă selectiv de acest factor de creștere și astfel blochează neo- angiogeneza . Combinat cu paclitaxel , acest tratament dublează timpul de răspuns (timpul până la progresia bolii). Pe de altă parte, nu există o creștere a timpului de supraviețuire.
Cu toate acestea, în Franța, în mai 2011 , Haute Autorité de Santé a concluzionat: „Având în vedere câștigul scăzut în supraviețuire fără recurență și lipsa îmbunătățirii supraviețuirii globale cu combinația bevacizumab / taxan versus taxan, beneficiul adăugării bevacizumab la paclitaxel este mai puțin bine stabilit astăzi. Acest interes este limitat la pacienții care sunt negativi pentru receptorii HER2 , estrogen și progesteron . " .
LapatinibLapatinib ( Tyverb ) administrat tratament oral este un inhibitor al tirozin intracelular al activității kinazei a receptorului HER2 și HER1 (EGFR). La pacienții care supraexprimă HER2, în progresia tumorii sub herceptină și care au primit deja antracicline și taxani, combinația lapatinib- capecitabină dublează timpul de răspuns în comparație cu capecitabina în monoterapie, fără a avea beneficii asupra supraviețuirii globale. Autorizația de introducere pe piață a fost obținută în 2008.
Terapia hormonală
În aproximativ două treimi din cancerele de sân, celulele canceroase au receptori hormonali în exces. Se spune apoi că tumoarea este sensibilă la hormoni, deoarece estrogenul stimulează proliferarea canceroasă prin acești receptori. În cancerul de sân, tratamentele hormonale vor acționa fie prin reducerea nivelului de estrogen din sânge și, prin urmare, prin stimularea receptorilor hormonali (castrare, anti-aromataze), fie prin blocarea receptorilor hormonali ( anti-estrogen ).
Supresia ovariană- chirurgical, prin laparotomie sau laparoscopie
- radiații, prin transformarea a 12 la 16 Cenușii în 4 până la 8 fracțiuni pe un bazin mic, după ce au identificat poziția ovarelor prin ultrasunete;
- Medical, de obicei folosind agoniști LHRH
- Leuprorelin , Enantone LP 3,75 mg / 4 săpt
- Goserelin , Zoladex 3,6 mg / 4 săpt
- Notă: Decapeptyl nu are autorizație de introducere pe piață pentru cancerul de sân.
-
Tamoxifen 20 mg d -1
- Mecanism: antagonist parțial al receptorilor de estradiol
- Precauție: efectuați examenul endometrial 1 / an, verificați funcția hepatică și trigliceridele, dozați estradiol în plasmă și adăugați LHRH dacă este contracepție crescută, eficientă (teratogenă).
-
Fulvestrant 250 mg IM la fiecare 28 de zile
- Mecanism: antagonist al receptorilor de estrogen fără acțiune agonistă parțială.
Utilizarea tamoxifenului este benefică dacă există receptori de estrogen în tumoră, indiferent de vârsta pacientului. Durata optimă de aplicare a terapiei hormonale adjuvante cu tamoxifen este de 5 ani la o doză de 20 mg d -1 . Utilizarea tamoxifenului reduce riscul de recurență cu 8% și riscul de deces cu 5%.
Anti-aromatazeDin 2004, pot fi oferite noi molecule femeilor aflate în postmenopauză. Aceștia sunt inhibitorii aromatazei . Cele două molecule cele mai evaluate sunt anastrozolul și letrozolul . Profilul lor de toxicitate este diferit de tamoxifen. Administrarea acestor două molecule face posibilă reducerea recidivelor după intervenția chirurgicală de cancer de sân, fără niciun beneficiu în ceea ce privește supraviețuirea generală ( versus tamoxifen).
-
Letrozol , Femara 2,5 mg d -1
- Mecanism: inhibitor nesteroidian al aromatazei
- Precauție: densitate osoasă, dislipidemie
-
Anastrozol , Arimidex 1 mg
- Mecanism: Inhibitori nesteroidieni ai aromatazei
- Precauție: densitate osoasă, dislipidemie
-
Exemestan , Aromasin 25 mg
- Mecanism: inhibitor de steroizi aromataza
- Precauție: densitate osoasă, dislipidemie
Prevenire: cum se reduce riscul
Știind că cancerul de sân este o boală hormonală, orice acțiune sau terapie care vizează reducerea duratei și intensității expunerii la estrogeni sau a perturbatorilor endocrini care imită acești estrogeni se presupune teoretic că este eficientă.
Acțiuni sau evenimente care reduc riscul
Mai multe tipuri de acțiuni pot fi întreprinse pentru a reduce riscul de a dezvolta cancer de sân.
Alegeri ginecologiceFactorii de risc au un numitor comun: creșterea impregnării hormonale a femeilor: directă, pentru tratamentele hormonale pentru menopauză, pilula de estrogen-progestogen, creșterea numărului de cicluri menstruale (număr scăzut de sarcini sau perioade scurte de alăptare), sau indirect prin creșterea activității enzimei aromatază în grăsimi, pentru alcool, supraponderalitate, lipsă de activitate fizică. Astfel, s-ar putea propune o prevenire primară a cancerului de sân, care să implice o modificare a stilului de viață
Alegerea pilulei contraceptiveAceasta este pentru a favoriza pastilele care nu conțin estrogen care blochează activitatea ovariană.
O primă sarcină la o vârstă fragedăScăderea vârstei primei sarcini reduce riscul de cancer mamar, deoarece ciclurile dintre pubertate și prima sarcină până la termen par cele mai periculoase din acest punct de vedere. Prima sarcină purtată până la termen ar acționa ca un vaccin împotriva cancerului prin diferențierea țesuturilor, făcându-le mai puțin vulnerabile la hormoni. Sarcina acționează, așadar, ca un vaccin împotriva estrogenilor. Cu cât apare mai devreme această primă sarcină, cu atât funcționează mai bine.
Alăptarea prelungităAlăptarea prelungită (deoarece adormirea ovarelor ) reduce riscul. Conform raportului WCRF , alăptarea aduce beneficii indiferent de momentul în care se dezvoltă cancerul (pre- sau post- menopauză ).
Evitarea terapiei hormonale a menopauzei (HRT)„Tratamentul hormonal pentru menopauză este acum considerat un factor de risc pentru cancerul de sân, mai ales atunci când este luat mai mult de 5 ani”, a raportat Le Figaro în 2008.
Alegerea stilului de viață Pierdere în greutateObezitatea și supraponderalitatea cresc riscul de cancer mamar. Profesorul Pierre Kerbrat (centrul Eugène-Marquis, Rennes) a estimat în 2008 că lupta împotriva obezității feminine ar preveni 13.000 de cazuri noi de cancer de sân pe an în Uniunea Europeană.
Exercițiu fizicPotrivit profesorului Kerbrat, practicarea a 30 de minute de activitate fizică, 5 zile pe săptămână, ar reduce numărul de cazuri noi cu 30% până la 40%. Efectul protector vine atât din lupta împotriva obezității, cât și din acțiunea exercițiului asupra secrețiilor hormonale. Studiile americane au arătat, de asemenea, efectul său preventiv împotriva reapariției bolii.
Reducerea consumului de alcoolRiscul de cancer mamar crește odată cu consumul de alcool. Consumul moderat de alcool crește riscul cu 20% până la 30%. Mai precis, riscul crește cu 10% atunci când consumul zilnic de alcool crește cu 10 g alcool (adică un pahar).
Alegeri alimentareAr reduce riscul.
- Realizat folosind chestionare de la 334.850 de femei cu vârste cuprinse între 35 și 70 de ani și incluse în cohorta EPIC (European Prospective Investigation on Cancer and Nutrition) (durata de urmărire: 11,5 ani), un studiu datataprilie 2013arată că nu există nicio legătură între consumul de flavonoizi și lignan ( fitoestrogeni ) și riscul de cancer mamar, indiferent dacă se ia în considerare sau nu starea menopauzei și starea receptorilor hormonali .
Acizii grași trans din sânge cresc riscul de cancer mamar al unei femei cu aproape 50%. De Acizii grași trans sunt folosiți în produsele alimentare prelucrate , cum ar fi paine, fursecuri industriale, produse de patiserie, prăjituri, chipsuri, pizza paste industriale.
- Ceai verde și / sau soia ar putea (sunt) au proprietăți protectoare (care ar explica faptul că , în Europa , 1 din 12 de femei dezvolta acest cancer, împotriva unul pentru 80 în Japonia , în cazul în care sunt consumate aceste alimente) .
- După apariția cancerului de sân, dublarea consumului de fructe și legume nu pare să scadă riscul de recurență.
- Suplimentarea cu Omega 3 a fost testată în 2008 pentru a vedea dacă a îmbunătățit chimioterapia.
- Nerespectarea tratamentelor hormonale ar reduce riscul de cancer mamar.
- Tratamentele de tip SERM ( tamoxifen , raloxifen ) ar reduce riscul. Cu toate acestea, aceste medicamente au efecte secundare semnificative (creșterea numărului de boli tromboembolice pentru cele două molecule, cancer endometrial pentru tamoxifen) și locul lor rămâne de stabilit.
Tratamente chirurgicale „preventive”
Au fost propuse tratamente chirurgicale preventive la femeile cu antecedente familiale de cancer de sân cu mutație în genele BRCA1 sau BRCA2. La aceste femei, riscul de cancer mamar variază între 40 și 85% înainte de vârsta de 80 de ani. Propunerile chirurgicale sunt fie îndepărtarea ambilor sâni cu sau fără ooforectomie bilaterală, fie ooforectomie bilaterală singură.
Studiile observaționale actuale privind mastectomia bilaterală preventivă (MBP) arată că aceasta ar putea reduce incidența cancerului de sân și / sau a decesului, deși aceste studii au limitări metodologice. Satisfacția în urma acestei proceduri pare a fi bună, cu îngrijorarea în scădere a cancerului, însoțită de scăderea imaginii corporale și a senzațiilor sexuale. La femeile care au avut cancer la un sân, îndepărtarea celuilalt sân pare să reducă incidența cancerului, dar efectul este incert asupra supraviețuirii pe termen lung din cauza riscului continuu de recurență sau metastazare a cancerului inițial.
Aspecte psihologice
Aflarea faptului că aveți cancer poate fi foarte dificil să vă împăcați, deoarece această știre a fost considerată de mult timp ca cea a morții iminente. În plus, spitalizarea, intervențiile chirurgicale și tratamentele adjuvante schimbă profund viața pacientului. Prin urmare, este esențial să se ofere pacienților sprijin psihologic adecvat, care implică, în general, participarea la grupuri de pacienți care trec prin aceleași încercări.
Cu toate acestea, cancerele de sân diagnosticate târziu sunt adesea foarte mutilante. Pentru femei, această mutilare mamară corespunde în general mutilării psihologice și sociale. Sânul fiind unul dintre cele mai puternice simboluri ale feminității , unele femei pot experimenta această mutilare ca o negare a feminității lor și, prin urmare, a personalității lor.
Relația de cuplu suferă adesea consecințele bolii. În perioada următoare tratamentului, pacientul sau partenerul ei pot exprima emoții negative, cum ar fi reproșuri. Acest tip de situație ar trebui luată în serios de profesioniști, deoarece poate fi asociată cu tulburări psihologice, cum ar fi depresia. Potrivit lui Nicolas Favez, Sarah Ciro Notari, Tania Antonini și Linda Charvoz, este posibil ca acest tip de situație să apară în stadiile incipiente ale bolii și chiar și atunci când prognosticul medical este optimist. În acest context, poate fi oferită o intervenție chirurgicală reconstructivă , însoțită de îngrijiri psihologice.
Prin urmare, cancerul de sân nu este doar o problemă medicală. Are impact asupra vieții, a corpului și a încrederii în sine. Când o femeie primește verdictul „cancerului de sân”, ea părăsește cabinetul medicului cu frică în stomac, cu multe întrebări despre cum va fi viața ei în viitor. Cum să vorbești despre asta rudelor sale? Cum să faci față căderii părului și a sprâncenelor? Cum să ieși din casa ta și să înfrunți privirea altora? Cum poți continua să ai grijă de copiii tăi? Va mai putea avea ceva? Își va pierde slujba? Ce se va întâmpla cu relația ei cu bărbatul din viața ei? Atât de multe întrebări, puține posibilități de dialog, multe tabuuri. Adesea femeile cad înapoi pe boală și acest lucru este chiar dăunător succesului terapiei.
Rămâne mult de făcut pentru a comunica corect cu pacienții și familiile acestora, dar și pentru a îmbunătăți concret îngrijirea medicală acordată femeilor și calitatea vieții lor în general.
În cultura populară
Comediana Marie Reno susține acțiunile de conștientizare a cancerului de sân cu piesa ei plină de umor Atenție la țâțe! .
Note și referințe
- https://www.francetvinfo.fr/sante/cancer/cancer-du-sein-il-y-a-une-vraie-recrudescence_1815585.html
- André Cicolella, Cancer de sân. Încheierea epidemiei , ed. Les Petits Matins, 2016.
- (în) PM Ravdin, Cronin KA, Howlader N și colab. „ Scăderea incidenței cancerului de sân în 2003 în Statele Unite ” , New Eng J Med , 2007; 356: 1670-1674
- "Scăderea incidenței cancerului de sân în 2005 și 2006 în Franța: un fenomen paradoxal" Buletinul Cancer , 2008; 95: 11-5
- (în) Forouzanfar MH, KJ Foreman, Delossantos AM și colab. „ Cancerul de sân și de col uterin în 187 de țări între 1980 și 2010: o analiză sistematică ” , Lancet , 2011
- Boyle și Ferley, 2004
- WCRF - Statistici privind cancerul de sân
- IARC - Fișă informativă pentru cancerul de sân
- Source Inserm 2008, consultat la 2008 10 04
- "Antoine Spire vorbește cu David Khayat pentru Le Monde de l'Education" extrase dintr-un articol publicat în aprilie 2006 în Le Monde de l'Education
- „Cancerul de sân avansat: promisiunile unui nou tratament” pe futura-sciences.com
- Institutul de Supraveghere a Sănătății Publice (INVS) INSERM
- „ Cancerul de san: spre tratamente mai puțin intensive “ (accesat la 1 st octombrie 2015 )
- Institutul Național al Cancerului, Cancerul de sân, actualizare aprilie 2008.
- „ Rac: supraviețuirea se îmbunătățește în Franța ” , pe sante.lefigaro.fr (accesat la 2 februarie 2016 )
- Wang B, He M, Wang L, Engelgau MM, Zhao W, Wang L. Screeningul cancerului de sân la femeile adulte din China, 2010. Prev Chronic Dis 2013; 10: 130136. DOI: https://dx.doi.org/10.5888/pcd10.130136
- (în) Nagata, Chisato, „ Factori de luat în considerare în asocierea dintre consumul de izoflavonă din soia și riscul de cancer mamar ” , J Epidemiol , vol. 20, n o 22009, p. 83-89 ( ISSN 1349-9092 , DOI 10.2188 / jea.JE20090181 , citiți online )
- Wooster R, Weber BL. Cancer de sân și ovarian . N Engl J Med 2003; 348: 2339-47
- Curs general de cancer P r JF HERON
- Loibl S, Poortmans P, Morrow M, Denkert C, Curigliano G, Cancer de sân , Lancet, 2021; 397: 1750-1769
- Isabelle Plo, Corentin Laulier, Fabienne Lebrun, Laurent Gauthier, Fabien Calvo și Bernard Lopez. AKT1 inhibă recombinarea omoloagă prin inducerea retenției citoplasmatice a BRCA1 și RAD51 . Cercetarea cancerului. 15 noiembrie 2008.
- [Tratamentele hormonale favoriza cancerul de sân? Comunicat de presă CEA]
- Comunicat / Cercetarea Universității Joseph-Fourier (Grenoble) ; [CK2: un rol important în progresia tumorilor mamare] ; 10 mai 2012
- Clavel-Chapelon F, Număr cumulativ de cicluri menstruale și risc de cancer mamar: rezultate din studiul de cohortă E3N al femeilor franceze , Cauze și control al cancerului, 2002; 13: 831-838
- Beral V, Cancer de sân și terapie de substituție hormonală în studiul a milioane de femei , Lancet, 2003; 362: 419-27
- Fetele ajung la pubertate mai devreme ca niciodată
- (în) Merrill RM Fugal S Novilla LB, Raphael ™, „ Riscul de cancer asociat cu vârsta maternă timpurie și târzie la prima naștere ” , Gynecol Oncol , Vol. 96, n o 3,2005, p. 583-93. ( PMID 15721398 , DOI j.ygyno.2004.11.038 )
- (ro) Faupel-Badger JM, Arcaro KF, Balkam JJ, Eliassen AH, Sherman ME și colab. , „ Remodelarea postpartum, lactația și riscul de cancer mamar: rezumatul unui atelier sponsorizat de Institutul Național al Cancerului ” , J Natl Cancer Inst , vol. 105, nr . 3,2013, p. 166-74. ( PMID 23264680 , PMCID PMC3611853 , DOI 10.1093 / jnci / djs505 , citiți online [html] )
- (ro) Diamanti-Kandarakis E, Bourguignon JP, Giudice LC și colab. , „ Produse chimice care perturbă endocrinul: o declarație științifică a societății endocrine ” , Endocr. Rev. , vol. 30, nr . 4,Iunie 2009, p. 293–342 ( PMID 19502515 , PMCID 2726844 , DOI 10.1210 / er.2009-0002 )
- Romain Loury (2015) În spatele cancerului de sân, DDT , 16 iunie 2015
- "Dr. de Lorgeril - Cauzele cancerului de sân au fost identificate în cele din urmă. Cum să vă protejați?"
- Celulele adipoase și cancerul de sân - o combinație periculoasă (conform unui comunicat de presă al CNRS) 2011/04/05
- Cancer de sân: sunt necesare campanii de prevenire , în Le Figaro , 23 octombrie 2008, pagina 11
- Risc crescut de cancer mamar la femeile aflate în postmenopauză în funcție de creșterea în greutate
- Béatrice Dirat; Adipocitele asociate cancerului prezintă un fenotip activat și contribuie la invazia cancerului de sân ; Cancer Research, doi: 10.1158 / 0008-5472.CAN-10-3323 Cancer Res 1 aprilie 2011 71; 2455 Rezumat )
- B. Dirat și colab. Cercetare in domeniul cancerului , 1 st aprilie 2011
- Studiu care arată corelația dintre cancerul de sân și consumul de grăsimi animale datând din 1986
- Studiu asupra factorilor identificați ai cancerului în Spania
- Aportul de grăsimi dietetice și riscul de cancer mamar: un studiu caz-control în China
- Concluziile lucrărilor Inserm și Institutul Gustave-Roussy au vizat evaluarea rolului diferiților acizi grași asupra dezvoltării cancerului de sân, din analize de sânge colectate din 1995 până în 1998 în rândul a 25.000 din 100.000 de femei urmate ca parte a -numit studiu E3N .
- (în) Factorul de creștere crește riscul de cancer
- (în) Laptele, produsele lactate și aportul de lactoză și riscul de cancer ovarian: o meta-analiză a studiilor epidemiologice , International Journal of Cancer , vol. 118, numărul 2, p. 431-441
- (in) Variația factorului de creștere asemănător insulinei plasmatice-1 și a factorului de creștere asemănător insulinei care leagă proteina-3: factori personali și de stil de viață (Statele Unite)
- „Raportul Andilor, p76 / 210”
- (în) „Consumul de lapte crud sau încălzit de la diferite specii: o evaluare a potențialelor beneficii nutriționale și pentru sănătate, p4 / 14
- (în) „Asocierea conținutului de IGF-1 cu lapte integral, cu conținut redus de grăsimi și cu conținut scăzut de grăsimi în Mexic”
- (în) Aportul de produse lactate, calciu și vitamina D și riscul de cancer mamar
- (în) Produse lactate și riscul de cancer mamar
- [PDF] Raport Alcool și risc de cancer (60 de pagini), Institutul Național al Cancerului și rețeaua Nacre, 2007)
- Xue F, Willett WC, Rosner BA, Hankinson SE, Michels KB, Fumatul și incidența cancerului de sân , Arch Intern Med, 2011; 171: 125-133
- (ro) Lundqvist J, M Norlin, Wikvall K, " 1α, 25-dihidroxivitamina D (3) exercită efecte specifice țesutului asupra metabolismului estrogenului androgenului " , Biochim Biophys Acta ,ianuarie 2011( PMID 21262387 , DOI 10.1016 / j.bbalip.2011.01.004 )
- (en) Napoli N, Vattikuti S, Ma C, și colab. , „ Prevalență ridicată a vitaminei D scăzute și a afecțiunilor musculo-scheletice la femeile cu cancer de sân ” , Breast J , vol. 16, n o 6,2010, p. 609–16 ( PMID 21070438 , DOI 10.1111 / j.1524-4741.2010.01012.x )
- (în) Grant WB, Peiris AN, " Rolul posibilului 25-hidroxivitamină serică D în disparitățile de sănătate alb-negru din Statele Unite " , J Am Med Dir Assoc , Vol. 11, n o 9,noiembrie 2010, p. 617–28 ( PMID 21029996 , DOI 10.1016 / j.jamda.2010.03.013 )
- (în) Engel P Fagherazzi G, S Mesrine, Boutron-Ruault MC, Clavel-Chapelon F, „ Efectele comune ale vitaminei D dietetice și ale expunerii la soare sunt risc de cancer mamar: rezultate din cohorta franceză E3N ” , Cancer Epidemiol. Biomarkeri Prev. , vol. 20, n o 1,ianuarie 2011, p. 187–98 ( PMID 21127286 , DOI 10.1158 / 1055-9965.EPI-10-1039 )
- (în) Densitatea mamografică și riscul de detectare a cancerului de sân și Norman F. Boyd, Helen Guo, Lisa J. Martin, Limei Sun, Jennifer Stone, Eve Fishell, Roberta A. Jong, Greg Hislop, Anna Chiarelli, Salomon Minkin, Martin J. Yaffe, New Eng J Med , 2007; 356: 227-236
- (ro) Travis LB, Hill D, Dores GM, Gospodarowicz M, van Leeuwen EF, Holowaty E și colab. „ Riscul cumulat de cancer de sân absolut pentru femeile tinere tratate pentru limfom Hodgkin ” J Natl Cancer Inst . 2005; 97: 1428-37
- (în) Einstein AJ, Henzlova MJ, Rajagopalan S, " Estimarea riscului de cancer asociat cu expunerea la radiații din angiografia coronariană cu tomografie computerizată cu 64 de felii " JAMA 2007; 298: 317-323
- (în) Kolstad HA, „ Nightshift work și riscul de cancer mamar și alte tipuri de cancer - o analiză critică a dovezilor epidemiologice ” Scand J Work Around Health . 2008; 34: 5-22
- Ciclurile cronice de lumină alternativă cresc riscul de cancer mamar la șoareci
- (ro) Wise J, „ Muncitorii danezi în schimbul de noapte cu cancer de sân după compensarea datei ” BMJ . 2009; 338: b1152
- (în) Stuebe AM, Willett WC, Fei Xue, Michels KB, „ Lactația și incidența cancerului de sân premenopauzal ”, Arch Intern Med . 2009; 169 (15): 1364-1371
- „Întreruperea voluntară a sarcinii nu mărește riscul de cancer mamar” (OMS, postat online în iunie 2000)
- Silva IdS, Stavola BD, McCormack V, Grupul colaborativ privind factorii de risc pre-natali și riscul ulterior de cancer de sân (2008), „ Dimensiunea nașterii și riscul de cancer de sân: re-analiză a datelor individuale ale participanților din 32 de studii ” ( Arhivă • Wikiwix • Archive.is • Google • Ce trebuie făcut? ) (Accesat la 2 august 2017 ) . PLoS Med 5 (9): e193
- Institutul Național împotriva Cancerului, cancerul de sân la bărbați .
- Maalej M, Hentati D, Messai T, Kochbati L, El May A, Mrad K, Romdhane KB, Ben Abdallah M, Zouari B. Cancerul de sân în Tunisia în 2004: un studiu clinic și epidemiologic comparativ. Rac de taur. 2008 februarie; 95 (2): E5-9.
- Antoniou A, Pharoah PD, Narod S et als. Riscuri medii de cancer mamar și ovarian asociate cu mutații BRCA1 sau BRCA2 detectate în seriile de caz neselectate pentru istoricul familial: o analiză combinată a 22 de studii , Am J Hum Genet, 2003; 72: 1117-1130
- Robson ME, Chappuis PO, Satagopan J, și colab. O analiză combinată a rezultatului după cancerul de sân: diferențe de supraviețuire bazate pe starea mutației BRCA1 / BRCA2 și administrarea tratamentului adjuvant , Breast Cancer Res 2004; 6: R8-R17
- Rennert G, Bisland-Naggan S, Barnet-Griness O și colab. Rezultatele clinice ale cancerului de sân la purtătorii de mutații BRCA1 și BRCA2 , N Engl J Med 2007; 357: 115-123
- John EM, Miron A, Gong G și Als. [2007; 298 (24): 2869-2876 Prevalența purtătorilor de mutație patogeni BRCA1 în 5 grupuri etnice rasiale / etnice din SUA ], JAMA, 2007; 298: 2869-2876
- Antoniou AC, Casadei S, Heikkinen T și colab. Riscul de cancer mamar la familiile cu mutații în PALB2 , N Engl J Med, 2014; 371: 497-506
- Cancer de sân in situ pe site-ul asociației pentru screeningul cancerului din Meurthe și Mosela, consultat la 13 ianuarie 2016
- „Cancerul de sân: iluziile screeningului”, Coisne S și Lemarchand F., La Recherche , 395, martie 2006: 44-48
- Humphrey LL, Helfand M, Chan BKS, Woolf SH, screeningul cancerului de sân: un rezumat al dovezilor pentru grupul de lucru al serviciilor preventive din SUA , Ann Intern Med , 2002: 137: 347-360
- Rezultatele studiului în două județe de screening mamografic nu sunt compatibile cu statisticile oficiale contemporane suedeze privind cancerul de sân . Zahl PH, Peter C. Gøtzsche , Andersen JM, Maehlen J. Dan Med Bull. 2006 noiembrie; 53 (4): 438-40.
- Berg WA, Blume JD, Cormack JB, screening combinat cu ultrasunete și mamografie vs mamografie singură la femeile cu risc crescut de cancer mamar JAMA, 2008; 299: 2151-2163
- Leach MO, Boggis CR, Dixon AK et als. Screening cu imagistică prin rezonanță magnetică și mamografie a unei populații din Marea Britanie cu risc familial ridicat de cancer mamar: un studiu prospectiv de cohortă multicentric (MARIBS) , Lancet, 2005; 365: 1769-78
- Kösters JP, Peter C. Gøtzsche , Autoexaminare regulată sau examen clinic pentru depistarea precoce a cancerului de sân , Cochrane Database of Systematic Reviews 2003, Numărul 2. Art. Nr.: CD003373. DOI: 10.1002 / 14651858.CD003373
- „Niramai folosește imagistica termică și AI pentru a revoluționa diagnosticarea cancerului de sân”
- „You tube, termografia mamară”
- „You tube: mamografie și imagistică termică”
- „Ncbi, 2014: un model nou pentru detectarea inteligentă a cancerului de sân în imaginile cu termograme”.
- „Martie 2017: instrument neinvaziv de susținere pentru diagnosticarea cancerului de sân folosind o cameră termografică ca senzor”
- „10Recenzii sistematice în farmacie, vol. 9, numărul 1, ianuarie-decembrie 2018, Efectul termografiei asupra detectării cancerului de sân”
- "2012, Slate: Cancer de sân: un scandal francez?"
- „Termografie pentru depistarea cancerului de sân”
- „Imagistica cu infraroșu a sânului - o prezentare generală, p18 / 22”
- [articol - [legat] "France-info, 2019: turistul britanic își descoperă cancerul de sân ... în timp ce vizitează un muzeu"]
- Warner E, screeningul cancerului de sân , N Engl J Med, 2011; 365: 1025-1032
- Miller AB, To T, Baines CJ, Wall C, Canadian National Breast Screening Study-1: mortalitatea prin cancer de sân după 11-16 ani de urmărire: un studiu de screening randomizat al mamografiei la femeile cu vârsta cuprinsă între 40 și 49 de ani , Ann Intern Med, 2002; 137: 305-312
- Moss SM, Cuckle H, Evans A, Johns L, Waller M, Bobrow L, Efectul screeningului mamografic de la vârsta de 40 de ani asupra mortalității prin cancer de sân la 10 ani de urmărire: un studiu controlat randomizat , Lancet, 2006; 368: 2053-2060
- Zackrisson S, Andersson I, Janzon L, Manjer J, Garne JP, Rata supra-diagnosticării cancerului de sân la 15 ani după încheierea studiului de screening mamografic Malmö: studiu de urmărire , BMJ, 2006; 332: 689-92
- Welch HG, Schwartz LM, Woloshin S, Ramificări ale screeningului pentru cancerul de sân: 1 din 4 tipuri de cancer detectate prin mamografie sunt pseudocanceri , BMJ, 2006; 332: 727
- Jørgensen KJ, Peter C. Gøtzsche , Overdiagnosis în programe de screening mamografice organizate public: revizuirea sistematică a tendințelor incidenței , BMJ, 2009; 339: b2587
- Zahl PH, Maehlen J, Welch HG, Istoria naturală a cancerelor de sân invazive detectate prin screening mamografic , Arch Intern Med, 2008; 168: 2311-6
- [1] .
- „Un defect al bacteriilor Methylobacterium în țesutul mamar canceros”
- "EverZen: Care este rata de supraviețuire a cancerului de sân?"
- din Cabarrot E. Istoricul natural al cancerului de sân. Enciclopedie medico-chirurgicală . Ediții științifice și medicale Elsevier SAS, Paris. Ginecologie, 865-A-10, 2000.
- Cancerul de sân inflamator: întrebări și răspunsuri pe site-ul Institutului Național al Cancerului .
- (în) X. Dai , „ Clasificarea subtipului intrinsec al cancerului de sân, utilizarea clinică și tendințele viitoare ” , Am J Cancer Res , vol. 5, n o 10,15 septembrie 2015, p. 2929–2943 ( citește online ).
- (în) E. Charaffe-Jauffret , " Profilarea expresiei genice a liniilor celulare mamare a identificat potențiali noi markeri bazali " , Oncogene , vol. 25,6 aprilie 2006, p. 2273–2284 ( citește online ).
- „Revoluția genomicii” , 1 min 33 s / 3 min
- „Terapie țintită 3m39 / 5m33”
- van 't Veer LJ, Dai H, van de Vijver MJ și Als. Profilarea expresiei genice prezice rezultatul clinic al cancerului de sân , Nature, 2002; 415: 530-536
- Paik S, Shak S, Tang G și Als. Un test multigen pentru a prezice reapariția cancerului de sân tratat cu tamoxifen, ganglionar negativ , N Engl J Med, 2004; 351: 2817-2826
- Wang Y, Klijn JG, Zhang Y și Als. Profiluri de expresie genică pentru a prezice metastaza la distanță a cancerului de sân primar cu ganglioni limfatici negativi , Lancet, 2005; 365: 671-679
- Înțeles MA, Somji S, Lamm DL, Garrett SH, Slovinsky F, Todd JH, Înțeles DA. Supraexpresia metalotioneinei izoformei 3 este asociată cu cancerele de sân cu prognostic slab . Am J Pathol 159: 21-26, 2001.
- Nartey N, Cherian MG, Banerjee D. Localizarea imunohistochimică a metalotioneinei în tumorile tiroidiene umane . Am J Pathol 129: 177–182, 1987.
- Haerslev T, Jacobsen K, Nedergaard L, Zedeler K. Detecția imunohistochimică a metalotioneinei în carcinoamele mamare primare și în metastazele lor ganglionare axilare. Pathol Res Pract 190: 675-681, 1994. 64.
- Haerslev T, Jacobsen K, Zedeler K. Semnificația prognostică a metalotioneinei detectabile imunohistochimic în carcinoamele mamare primare. APMIS 103: 279-285, 1995.
- Fresno M, Wu W, Rodriguez JM, Nadji M. Localizarea metalotioneinei în carcinoamele mamare. Un studiu imunohistochimic. Virchows Arch A Pathol Anat Histopathol 423: 215-219, 1993.
- 5TH CONFERINȚĂ INTERNAȚIONALĂ Metallotionein SIMPOZION LUCRARI Metallotionein ca un biomarker Prognostic in cancer de san Boon-Huat Bay, Rongxian Jin, Jingxiang Huang și Puay-Hoon Tan ( „ Rezumat “ ( Arhiva • Wikiwix • archive.is • Google • Ce să fac? ) (accesat la 2 august 2017 ) și „ articol PDF complet (6 pagini) ” ( Arhivă • Wikiwix • Archive.is • Google • Ce să faci? ) (accesat la 2 august 2017 ) )
- Ioachim E, Tsanou E, Briasoulis E, Batsis Ch, Karavasilis V, Charchanti A, Pavlidis N, Agnantis NJ. Studiu clinicopatologic al expresiei hsp27, pS2, catepsină D și metalotioneină în cancerul de sân primar invaziv . Sânul 12: 111-119, 2003.
- Surowiak P, Matkowski R, Materna V, Gyorffy B, Wojna A, Pudelko M, Dziegiel P, Kornafel J, Zabel M. Expresia crescută a metalotioneinei (MT) în cancerul de sân ductal invaziv prezice rezistența la tamoxifen . Histol Histopathol 20: 1037-1044, 2005.
- [PDF] Site-ul web al Organizației Naționale a Sindicatelor Asistenților Liberali
- Mansel RE, Fallowfield L, Kissin M et als. Studiu randomizat multicentric al biopsiei nodului santinelă versus tratamentul axilar standard în cancerul de sân operabil: studiul ALMANAC , J. Natl Cancer Inst. , 2006; 98: 599-609
- Erica J Weinstein , Jacob L Levene , Marc S Cohen și Doerthe A Andreae , „ Anestezice locale și anestezie regională versus analgezie convențională pentru prevenirea durerii postoperatorii persistente la adulți și copii ”, Cochrane Database of Systematic Reviews ,21 iunie 2018( ISSN 1465-1858 , PMID 29926477 , PMCID PMC6377212 , DOI 10.1002 / 14651858.cd007105.pub4 , citit online , accesat la 21 iulie 2020 )
- (ro) Clarke M, Collins R, S Darby și colab. „Efectele radioterapiei și ale diferențelor în ceea ce privește amploarea intervenției chirurgicale pentru cancerul de sân precoce asupra recurenței locale și supraviețuirii pe 15 ani: o privire de ansamblu asupra studiilor randomizate” Lancet 2005; 366: 2087-106
- (ro) Henson KE, McGale P, Taylor C, Darby SC. „Mortalitatea cauzată de radiații din cauza bolilor de inimă și a cancerului pulmonar la mai bine de 20 de ani după radioterapia pentru cancerul de sân” British Journal of Cancer 20 decembrie 2012 DOI : 10.1038 / bjc.2012.575
- „ Cancerul poate fi tratat în timpul sarcinii ” (accesat la 2 octombrie 2015 )
- „ Cancerul de sân: un test de sânge pentru a prezice impactul radioterapiei ” , pe revista Santé (accesat pe 27 ianuarie 2016 )
- (ro) Romond EH, Perez EA, Bryant J și colab. „Trastuzumab plus chimioterapie adjuvantă pentru cancer mamar operabil HER2-pozitiv” N Engl J Med. 2005; 353: 1673-84
- " Medscape France - Informații și resurse medicale pentru medici | Medscape France ” , pe francais.medscape.com (accesat la 4 septembrie 2018 )
- (ro-GB) John Wiley & Sons Ltd și The Atrium, Southern Gate , „ Ontruzant lansează pentru a deveni primul Herceptin biosimilar disponibil în Marea Britanie | Pharmafile ” , pe www.pharmafile.com (accesat la 4 septembrie 2018 )
- (ro) Miller K, Wang M, Gralow J și colab. „Paclitaxel plus bevacizumab versus paclitaxel singur pentru cancerul de sân metastatic” N Engl J Med. 2007; 357: 2666-76.
- Rezumatul avizului Haute Autorité de Santé (Franța), mai 2011
- (ro) Geyer și colab. „Lapatinib plus Capecitabină pentru cancerul de sân avansat HER2-pozitiv” ( Arhivă • Wikiwix • Archive.is • Google • Ce să faci? ) (Accesat la 2 august 2017 ) N Engl J Med. 2006; 355: 2733-43.
- Pentru Anastrozol , mai puțin cancer endometrial, mai puțină ischemie cerebrovasculară, mai puține tromboze venoase profunde, dar mai multe fracturi și artralgii. Pentru Letrozol , mai puține evenimente tromboembolice venoase, dar mai multe artralgii, fracturi, probleme cardiace și colesterol ridicat
- Colditz, GA și Bohlke, K. (2014), Priorități pentru prevenirea primară a cancerului de sân. CA: A Cancer Journal for Clinicians, 64: 186–194. doi: 10.3322 / caac.21225
- Programul monografic IARC clasifică contraceptivele combinate combinate și terapia cu hormoni monopauzali drept agenți cancerigeni , Agenția Internațională pentru Cercetarea Cancerului , 29 iulie 2005 comunicat de presă
- (en) Chavez-MacGregor M Elias SG, Onland-C Moret și colab. Riscul de cancer mamar postmenopauză și numărul cumulat de cicluri menstruale , Cancer Epidemiology Biomarkers & Prevention, 2005; 14: 799-804
- "Cancer de sân: campanii de prevenire sunt solicitate pentru" Le Figaro , 23 octombrie 2008
- (în) E. Riboli și colab. " Investigațiile prospective europene asupra cancerului și nutriției (EPIC) studiază populațiile și colectarea datelor " Nutriție pentru sănătatea publică , vol. 5, n o 6B,2002, p. 1113-1124 ( PMID 12639222 , citit online [html] , accesat la 16 aprilie 2013 )
- (în) R. Zamora-Ros și colab., „ Flavonoidul dietetic și aportul de lignan și riscul de cancer mamar în funcție de menopauză și statusul receptorilor hormonali în studiul european de cercetare prospectivă în cancer și nutriție (EPIC) „ Cercetarea și tratamentul cancerului de sân ,2013( PMID 23572295 , citit online [html] , accesat la 16 aprilie 2013 )
- Concluzia unui studiu privind alimentația și viața sănătoasă pentru femei (WHEL), publicat în vara anului 2007 în JAMA
- Experiment realizat de INSERM în Tours (sursă: Science et Avenir din aprilie 2008)
- Bevers, Therese B, Dovezi pentru Raloxifen ca agent de reducere a riscului de cancer mamar pentru femeile aflate în postmenopauză , JNCCN, 2007; 5: 817-822
- Nelson HD, Smith MB, Griffin JC, Fu R, Utilizarea medicamentelor pentru reducerea riscului de cancer primar de sân , Ann Intern Med, 2013; 158: 604-614
- (în) Nora E Carbine , Liz Lostumbo Judi Wallace și Henry Ko , „ Mastectomia care reduce riscul pentru prevenirea cancerului mamar primar ” , Cochrane Database of Systematic Reviews ,5 aprilie 2018( PMID 29620792 , PMCID PMC6494635 , DOI 10.1002 / 14651858.CD002748.pub4 , citit online , accesat la 13 mai 2019 )
- (în) Nicolas Favez , Sarah Cairo Notari , Tania Antonini și Linda Charvoz , „ Atașarea și satisfacția cuplului ca predictori ai emoției exprimate la femeile care se confruntă cu cancerul de sân și partenerii lor în perioada imediat postoperatorie ” , British Journal of Health Psychology , zbor. 22, n o 1,1 st februarie 2017, p. 169–185 ( ISSN 2044-8287 , DOI 10.1111 / bjhp.12223 , citit online , accesat la 23 august 2017 )
- „ Marie Reno - Pink October - Topul știrilor - 27 septembrie 2019 - Marie Réno - Topul știrilor de pe Rire & Chansons - Rire & Chansons ” , pe Rire & Chansons.fr (accesat la 7 octombrie 2019 )
Vezi și tu
Articole similare
- Sân
- Cancer ovarian
- Cancerul uterin
- Mastectomie , proteză
- Mitoxantronă
- Tulburări cognitive post-chimioterapie
- Atossa
- Oncotip DX
- Seintinelles
linkuri externe
- Înregistrări de autoritate :
- Observații în dicționare generale sau enciclopedii : Brockhaus Enzyklopädie • Encyclopædia Britannica
- Resurse legate de sănătate :
- ICD-10 Versiune: 2016
- MalaCards
- Institutul Național al Cancerului
- Tezaurul NCI
- Orphanet
- (ro) Clasificarea internațională a asistenței primare
- (ro) Ontologie a bolilor
- (ro) DiseasesDB
- ( fr ) Patrimoniul mendelian la oameni
- ( fr ) Patrimoniul mendelian la oameni
- (sv) Internetmedicin
- (en + es) MedlinePlus
- (nu + nn + nb) Magazin medisinske leksikon
- Cancerul de sân pe site-ul web al asigurărilor de sănătate
- www.cancerdusein.org Site-ul „Asociației pentru cancerul de sân, Parlons-en! », La originea lunii octombrie Rose a crescut conștientizarea despre lupta împotriva cancerului de sân și a depistării precoce, în Franța din 1994
- Cancer de sân pe site-ul Federației Naționale pentru Lupta împotriva Cancerului
- Categoria cancerului de sân din directorul dmoz
- GRCS, grupul de cercetare a cancerului de sân al centrului de cercetare CHUM din Montreal
- Radio Curie Un webradio de informare dedicat femeilor cu cancer de sân și celor dragi